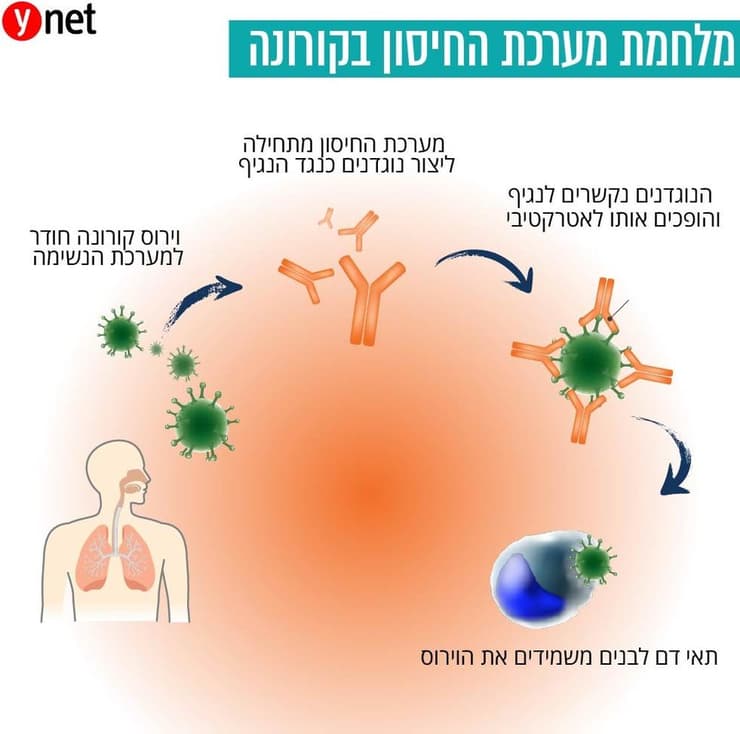
חיסונים הם ממצילי החיים הגדולים בתולדות האנושות, המונעים תחלואה, אשפוזים ותמותה. חיסונים מבוססים על ''אימון'' המערכת החיסונית שלנו להתמודדות עם מחולל מחלה חדש ולא מוכר. כשמערכת החיסון מזהה גורם זר, היא מפתחת נוגדנים ספציפיים שמנטרלים את הפולש ומאפשרים לתאי מערכת החיסון להשמידם. החיסון מציג למערכת החיסון את מחולל המחלה כשהוא מומת או מוחלש או חלק ממנו כך שהוא אינו יכול לגרום למחלה, אך באופן שמעורר יצירה של נוגדנים כנגדו. הנוגדנים יגנו על הפרט המחוסן בעת הידבקות במחולל המחלה האמיתי, וימנעו תחלואה.
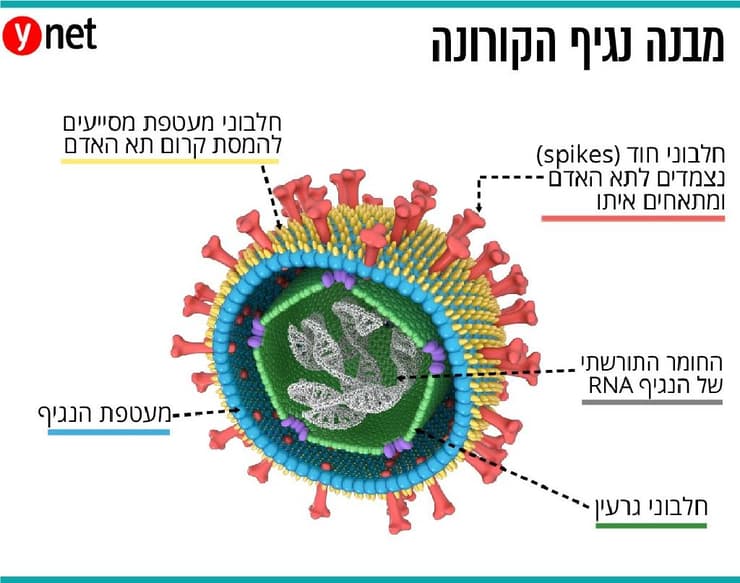
נגיפים גורמים למחלות רבות של בני אדם, משפעת וחצבת ועד איידס, בהן מחלות קטלניות במיוחד כמו כלבת, אבולה ואבעבועות שחורות. נגיפים (וירוסים) הם טפילים מיקרוסקופיים התלויים בתא מאכסן כדי להתרבות. הם מורכבים מחומר תורשתי - DNA או RNA - נתון בקופסית המורכבת ממספר מצומצם של חלבונים, ולעתים עטופה במעטפת שומנית. לאחר פלישה של הנגיף לתא המאכסן, הוא משתלט על מערכות התא, משכפל את עצמו באמצעותן ובסופו של דבר מביא להרס התא המאכסן.
קורונה הוא נגיף RNA מתפרץ, שלא היה מוכר למדענים בעבר ולכן לא נחקר באופן נרחב. פיתוח חיסונים לנגיפים מתפרצים מציב אתגרים ייחודיים במספר רמות, אך העיקרי שבהם הוא הזמן.
השלב הראשון בפיתוח חיסון חדש כולל בידוד הנגיף וגידולו בתנאי מעבדה. מכיוון שהוא טפיל, יש לגדלו בתוך תאים, ואפשר לעשות זאת בתרביות תאים או בביצים מופרות של תרנגולות. שבועות אחדים לאחר גילוי הנגיף, הצליחו חוקרים מכמה מעבדות בעולם לגדל אותו בתרביות תאים, שלב חיוני המאפשר לחקור את הביולוגיה הבסיסית של הנגיף ולמצוא את נקודות התורפה שלו.
צפו: כל מה שידוע על נגיף הקורונה עד כה
מוחלש או מומת: גישות שונות ליצירת חיסונים
לאורך השנים, התפתחו מספר גישות ליצירת חיסונים. בחיסון חי מוחלש, מגדלים את הנגיף הטבעי בתאים שמקורם במאכסן אחר. כדי להתרבות בתאים האלה הנגיף יעבור מוטציות וישתנה. לאחר מספר רב של מעברים כאלו, הנגיף יתקשה לגדול במאכסן המקורי, ויהפוך למוחלש. הנגיף המוחלש אינו גורם למחלה, אבל מערכת החיסון שלנו יכולה לזהות ולהשמיד אותו, ובכך לרכוש הגנה גם נגד הנגיף המקורי והאלים. אם הביולוגיה של הנגיף מוכרת והחוקרים מכירים חלבונים החיוניים להתרבות והישרדות הנגיף בתאי המאכסן, אפשר ליצור מוטציות מכוונות בחלבונים אלו ליצירת נגיף מוחלש שיכול לשמש לחיסון.
לגישה זאת יש כמה יתרונות, בהם הפעלה של תגובה חיסונית חזקה. בשל כך, תרכיבים כאלו מצריכים לרוב פחות מנות חיסון, דבר שמפחית את העלויות ומשפר את ההיענות לקבלת החיסון.
עם זאת, תרכיב חי מוחלש אינו מתאים לשימוש אצל אנשים שמערכת החיסון שלהם מדוכאת, כמו למשל מושתלי איברים המקבלים תרופות לדיכוי חיסוני כדי למנוע דחיית השתל, או חולים בסוגים מסוימים של סרטן. בנוסף, קיים סיכוי נמוך לתופעה נדירה של רוורסיה - הנגיף המוחלש עובר מוטציה נקודתית שמאפשרת לו לגדול ולשגשג במאכסן המקורי, מה שהופך אותו לאלים.
לרוב, חיסונים חיים מוחלשים אינם מתאימים עבור נגיפים מתפרצים שכן הם אינם מאופיינים מספיק והסיכון לרוורסיה לזן אלים עלול להיות גבוה. לכן גישה זו אינה מתאימה לפיתוח חיסון עבור SARS-CoV-2.
גישה אחרת היא שימוש בנגיף מומת. בשיטה זו ממיתים את הנגיפים באמצעות שימוש בחומרים כימיים, חשיפה לקרינה או הרתחה. את הנגיפים המומתים מזריקים לגוף, ומערכת החיסון מזהה מרכיבים שלהם ומפעילה תגובה חיסונית. ברוב המקרים, התגובה החיסונית שנוצרת פחותה יחסית לתגובה שמעורר חיסון חי מוחלש, ולכן יש לשלב בתרכיב החיסון גם אדג'ובנט, חומר שמגביר את התגובה החיסונית. כמו כן יש לתת כמה מנות של החיסון. למרות זאת, בגלל שאין סכנה לרוורסיה, אפשר להשתמש בחיסונים אלה גם אצל מדוכאי חיסון ואוכלוסיות אחרות בסיכון.
הנדסת נגיפים
מאחר שנגיף הקורונה אינו מוכר למערכת החיסונית שלנו, חיסון שמבוסס על נגיף מומת אינו מספיק לעיתים כדי לעורר תגובה חיסונית שתספק הגנה כנגדו. כמו במקרה של מספר חיסונים מומתים לאבולה, שלא הצליחו לעורר תגובה חיסונית מספקת ונגנזו.
כדי להתגבר על כך, אפשר לנסות שיטה שנמצאת בשלבים קליניים מתקדמים לפיתוח חיסון נגד נגיף אבולה, rVSV-ZEBOV. בשיטה זו משתמשים בנגיף נשא שאינו מסוכן לבני אדם, מסוג Vesicular stomatitis Indiana virus (VSIV) ומהנדסים אותו כך שיבטא חלבון מסוים של הנגיף שאנו מעוניינים לפתח חיסון נגדו.
נגיף VSIV מדביק חרקים, סוסים וחזירים אך אינו מסוגל להדביק בני אדם. כדי לייצר באמצעותו חיסון נגד אבולה, מהנדסים אותו כך שיבטא את חלבון המעטפת העיקרי של אבולה על גבי המעטפת החיצונית שלו. כך מתקבל נגיף היברידי שמצד אחד מעורר תגובה חיסונית חזקה מצד אחד כמו בחיסון חי מוחלש, אבל מצד שני אינו יכול לעבור רוורסיה ולהפוך למסוכן. במחקר ישראלי גרמני בהשתתפות קבוצתו של ד"ר רון דיסקין ממכון ויצמן למדע, התקבלו תוצאות מבטיחות עם התרכיב הניסיוני נגד אבולה, כך ששיטה זו יכולה להיות ישימה גם במקרה של וירוס הקורונה החדש.
חלקים של נגיפים
במקום להשתמש בנגיף שלם, אפשר לבודד מתוכו רכיב מסוים, המכונה אַנְטִיגֵן, שנגדו תופעל התגובה החיסונית. בחירת האנטיגן מצריכה הבנה של הביולוגיה הבסיסית של הנגיף, ומתבססת על מחקר מקדים לזיהוי האנטיגן שמעורר את התגובה החיסונית הטובה והספציפית ביותר.
מאחר שהקורונה הוא נגיף חדש, הידע הקיים לגבי אנטיגנים אפשריים עדיין מצומצם. עם זאת, כלים טכנולוגיים מתקדמים מסייעים למדענים לקדם את המחקר לפיתוח תרכיב נגד הנגיף ומציאת אנטיגנים אפשריים. כך למשל, זמן קצר לאחר התפרצותו, כבר היה בידי החוקרים הרצף הגנטי של הנגיף החדש, אשר מאפשר שימוש במודלים לבחירה מושכלת של אנטיגנים אפשריים.
בזכות ממצאים אלו, חוקרים מגרמניה הראו כי הנגיף חודר לתאי המטרה באמצעות היצמדות חלבון S שמתבטא על גבי הנגיף, לחלבון ACE2 שמתבטא על גבי תאי אפיתל בדרכי הנשימה. חוקרים מנסים כעת לפתח חיסון שיפעיל תגובה חיסונית נגד חלבון S, שהוא אנטיגן אפשרי, וכך לפגוע ביכולת של הנגיף לחדור לתאים.
מאחר שמדובר בנגיף לא מוכר ומסוכן, האפשרות לגדל אותו בכמויות גדולות המספיקות לייצור חיסונים מוגבלת ביותר. לפיכך, יש ליישם שיטות של הנדסה גנטית לייצור האנטיגן. לשם כך מהנדסים גנטית חיידקים, תאי חרקים או אפילו תאי אדם ומחדירים ל-DNA שלהם את הגנים של הנגיף שמקודדים את ייצור האנטיגן. התאים הופכים למעין 'בית חרושת' ומייצרים כמות גדולה של האנטיגן הנבחר. לאחר שמבודדים ומנקים את החלבון האנטיגני, אפשר לשלב אותו בחיסון.
הטכנולוגיה הזו יושמה לאחרונה לפיתוח חיסון רקומביננטי לשפעת המתבסס על ייצור חלבוני הֶמאַגְלוּטִינִין בתרביות של תאי חרקים. גם החיסון נגד נגיף פפילומה הוא חיסון רקומביננטי המורכב מחלבוני המעטפת של הנגיף המיוצרים בתאי שמרים או חרקים. החלבונים הרקומביננטיים יוצרים מעין חלקיק נגיף ריק, שאינו יכול להתרבות או להזיק, אך מאפשר למערכת החיסון שלנו לייצר נוגדנים הנקשרים אליו וכך מגנים עלינו מפני הדבקה כשהם פוגשים בנגיף האמיתי.
חיסון עם חומר גנטי
גישה חדשנית נוספת לפיתוח חיסונים היא חיסונים המבוססים על חומר גנטי של הנגיף, כלומר RNA או DNA. תרכיב כזה אינו מתבסס על האנטיגן החלבוני עצמו אלא על הרצף הגנטי שמקודד לייצורו.
בחיסוני RNA, במקום לייצר ולנקות כמות גדולה של האנטיגן במעבדה, מזריקים רצף של RNA שליח (mRNA) שמקודד ליצירת האנטיגן בתאי המאכסן עצמו. לאחר הזרקת התרכיב, רצף ה-RNA יתורגם בתאי המאכסן ליצירת האנטיגן. מערכת החיסון מזהה את האנטיגן הזה כגורם זר, ומפעילה תגובה חיסונית נגדו. העקרון של חיסוני DNA זהה, וכולל הזרקה של רצף DNA מעגלי המקודד ליצירת אנטיגן רצוי. כמו בכל ייצור של חלבון, ה-DNA מועתק בתאים ל-RNA שליח, ועל פיו מייצר התא את החלבון.
מולקולות של DNA ו-RNA אינן נכנסות לתאים באופן יעיל. לפיכך, תרכיבי חיסון אלו חייבים לכלול חומרים שייצבו אותן ויאפשרו להחדירן לתאים. חוקרים מנסים לשלב RNA או DNA עם ננו-חלקיקים ליפידיים או עם פולימרים אשר מייצבים את מבנה ה-RNA וכן משמשים מעין נשא שמחדיר אותו לתאי המטרה.
למרות שחיסוני DNA הם לרוב יציבים יותר, חיסוני RNA לרוב מצליחים לייצר תגובות חיסוניות חזקות יותר, ולכן יישימים יותר עבור נגיפים מחוללי מחלה.
חיסון עם הגברה
קיימות שתי גישות בפיתוח חיסוני RNA: הראשונה מתבססת על הזרקת ה-RNA עצמו ללא שום הגברה בעוד השניה מאפשרת הגברה של ה-RNA בתאי המטרה ומכונה Self-amplifying mRNA vaccines. בגישה זו מתקבל חיסון RNA שמסוגל להגדיל את כמותו וכך, בתקווה, ליצור תגובה יעילה יותר. כדי להשיג הגברה מהנדסים נגיף קטן מסוג אלפא-וירוס כך שבמקום את החומר הגנטי שמשמש לייצור חלבוני המעטפת שלו, הוא נושא את רצף ה-RNA שמקודד ליצירת האנטיגן של הנגיף שאנו רוצים לחסן נגדו.
כך הנגיף המהונדס חודר לתאים באתר ההזרקה, והתאים מייצרים בעזרת ה-RNA שלו כמות גדולה של האנטיגן, בעוד הנגיף המהונדס אינו מסוגל להדביק תאים נוספים. כתוצאה מכך, מתקבלת הגברה של כמות האנטיגן הנוצר בכל תא, מה שמאפשר לקבל תגובה חיסונית חזקה נגד האנטיגן שלנו, במינון נמוך יותר של התרכיב. כמה חברות מנסות ליישם שיטה זו לפיתוח של חיסונים נגד נגיף זיקה, כלבת, שפעת ו-HIV - הנגיף הגורם לאיידס. בכמה מחקרים מצאו כי גישה זו אכן מייצרת תגובה חיסונית חזקה ויעילה נגד האנטיגן, אך עלולה להיות הגבלה על מספר מנות החיסון שכן מתפתחת תגובה חיסונית גם נגד הנגיף.
אחד היתרונות של חיסוני RNA הוא שגישה זאת מגוונת ומאפשרת מודולריות וגמישות. אם יימצא תרכיב יציב אשר מאפשר ביטוי יעיל של האנטיגן הנבחר ומעורר תגובה חיסונית חזקה אפשר יהיה לשנות את רצף ה-RNA בהתאם למחוללי מחלה שונים ולייצר תרכיבים במהירות. בנוסף, מדובר בגישה מהירה וזולה יחסית, שכן היא עוקפת את התהליך המסורבל והארוך של ייצור אנטיגנים במעבדה וניקויים.
עם זאת, יש לשיטה גם חסרונות, כשהעיקרי שבהם הוא הצורך להכיר את הביולוגיה הבסיסית של הנגיף כדי לבחור אנטיגן מתאים. למרות שמדובר בשיטה מבטיחה, מספר תרכיבים שהשיגו תוצאות חיוביות בניסויים בבעלי חיים הניבו תוצאות הרבה יותר צנועות בניסויים קליניים בבני אדם, כך שעד כה לא אושר אף חיסון RNA לשימוש לבני אדם והמחקר בתחום זה נמשך.
לחיסוני RNA יש יישום אפשרי נוסף ומסקרן בייחוד בהקשר של נגיפים מתפרצים. חיסונים פעילים אמנם מונעים הדבקה ותחלואה, אך מה לגבי מי שכבר נחשפו וחלו? במקרים כאלו משתמשים לעיתים בחיסון פסיבי. זהו למעשה עירוי של נוגדנים נגד מחולל המחלה אשר מיוצרים באופן מלאכותי במעבדה או מופקים מדם של חולים שהחלימו. המגבלה העיקרית של חיסונים פסיביים היא העלות הגבוהה שלהם והכמות המועטה שאפשר לייצר או להפיק בכל פעם, ביחד עם אחוזי הצלחה משתנים.
כדי לעקוף מגבלות אלו, מספר קבוצות מנסות ליישם את טכנולוגיית חיסוני ה-RNA לייצור נוגדנים נגד מחולל המחלה ישירות באתר ההדבקה. כך למשל, קבוצת מחקר מארה''ב הצליחה לייצר חיסון RNA של נוגדנים נגד נגיף RSV, הניתן באינהלציה ומוביל ליצירת נוגדנים ישירות בריאות של עכברים מודבקים. אמנם מדובר בשלבי מחקר מוקדמים ביותר, אך בעלי פוטנציאל רב.
השלבים בפיתוח חיסון
מעבר לשלבי הפיתוח הטכניים, פיתוח של חיסון חדש מורכב משלבים רגולטוריים רבים שנועדו לבחון את יעילותו ובטיחותו. אפשר לחלק את שלבי הפיתוח לשלבים טרום-קליניים ושלבים קליניים.
השלבים הטרום-קליניים נמשכים בדרך כלל בין שנה לחמש שנים ומבוצעים במעבדות מחקר באקדמיה או בתעשיית התרופות. שלבים אלו כוללים את בידוד הנגיף, גידולו בתנאי מעבדה ובחינת הגישה החיסונית המתאימה באמצעות ניסויים בתרביות ובחיות מעבדה. לאחר שנמצאה גישה חיסונית מתאימה, מתחילים בבדיקת התרכיב הראשוני בחיות מעבדה כדי להעריך את בטיחותו ויעילותו במניעת הדבקה.
לאחר שהצטברו די ראיות ליעילות התרכיב ובטיחותו בבעלי חיים, אפשר להתחיל לבחון את התרכיב החדש בבני אדם. זהו השלב הקליני בפיתוח התרכיב, והוא מתחלק לארבעה שלבים.
בתחילה, מזריקים את התרכיב למספר מצומצם של מתנדבים בריאים (עד מאה) כדי להעריך את בטיחות השימוש בו. בשלב זה מתעדים תופעות לוואי ומתחילים להעריך את התגובה החיסונית במינונים שונים של התרכיב. לעיתים, שלב זה יהיה מורכב מכמה תת-שלבים. כך למשל, בתרכיבים המיועדים לפעוטות יבצעו כמה תת-מחקרים בקבוצות גיל נפרדות: תחילה התרכיב ייבדק במבוגרים, לאחר מכן במתבגרים, בילדים ולבסוף בפעוטות.
בשלב השני מזריקים את התרכיב למדגם גדול יותר, כמה מאות מתנדבים, שייחשפו לאחר מכן למחולל המחלה. החשיפה יכולה להיות טבעית או מלאכותית, שבה חושפים אותם לגירסה מוחלשת של הנגיף. גם בשלב זה מעריכים את הבטיחות של התרכיב, מתעדים תופעות לוואי ובוחנים את התגובה החיסונית שנוצרת בהשוואה לתרכיב פלצבו או לחיסון קיים. כך למשל, בודקים אם אפשר למצוא נוגדנים נגד מחולל המחלה בדמם של מתנדבים שקיבלו את החיסון ואם מי שקיבלו את החיסון אכן מוגנים יותר מתחלואה יחסית לקבוצת הביקורת. בשלב זה מתבצעת אופטימיזציה נוספת של המינון ומספר מנות החיסון הדרושות.
בשלב השלישי, מתבצע מחקר קליני רחב, הכולל אלפי משתתפים, בכמה מרכזים רפואיים ומחקריים באזורים שונים. בשלב זה מנסים לאסוף מידע משמעותי מבחינה סטטיסטית לגבי יעילות החיסון בתנאי חשיפה טבעית למחולל המחלה. בחירת המרכזים מתבצעת בהתאם לתפוצת המחלה, ואמורה לשקף את המצב האמיתי. כך למשל, חיסון חדש שמיועד למחלה שנפוצה במדינות מתפתחות יהיה חייב לכלול מרכזים במדינות אלו.
אם התרכיב יעיל במניעת המחלה בהשוואה לאוכלוסייה הלא מחוסנת, וממשיך להיות בטיחותי מבחינת תופעות הלוואי המתועדות, יצרן החיסון רשאי בשלב זה להגיש את ממצאי המחקרים הפרה-קליניים והקליניים לרשות הרגולטורית ולבקש הרשאה לשיווק החיסון בבני אדם. בארצות הברית הרשות שמאשרת חיסונים היא מינהל המזון והתרופות (FDA) ואילו באירופה זו סוכנות התרופות האירופית (EMA). בארץ הסמכות נתונה בידי משרד הבריאות, לאחר שוועדה מקצועית בוחנת את נתוני המחקר הקליני. אם הרשות הרגולטורית מתרשמת לטובה מהישגי החיסון ויכולתו להגן על בני אדם מפני הנגיף, החיסון יאושר לשימוש בבני אדם עם התוויה מסוימת מבחינת המינון, מספר המנות ואוכלוסיית היעד.
השלב הקליני בפיתוח חיסון חדש נמשך שנים אחדות, תלוי בסוג החיסון ובאוכלוסיות היעד. השלב הרביעי בפיתוח החיסון מתרחש לאחר שהוא נכנס לשגרת החיסונים ולשימוש כללי. כעת הוא ניתן למאות אלפי אנשים, ואף מיליונים, מה שמאפשר זיהוי של תופעות לוואי נדירות יותר והערכת יעילותו של החיסון לאורך זמן.
איפה עומד החיסון לנגיף הקורונה החדש?
המירוץ לפיתוח חיסון נגד נגיף הקורונה כבר החל, והפיתוח הטרום-קליני נמצא בעיצומו. במספר רב של חברות תרופות, מרכזי מחקר ואוניברסיטאות. מביניהן, המתקדמת ביותר היא חברת מודרנא (Moderna Therapeutics) מסיאטל שבארצות הברית, אשר פיתחה תרכיב mRNA שמקודד ליצירת חלבון S של הנגיף, המאפשר לו לחדור לתאי האפיתל בדרכי הנשימה. החברה הגישה את התרכיב לבחינה במרכז הלאומי האמריקאי לאלרגיה ומחלות זיהומיות (NIAID).
לאחר שיתקבל אישור של NIAID לכך שהתרכיב עומד בתקני ייצור מחמירים הנדרשים עבור חיסונים, החברה תוכל להתחיל בניסוי קליני ראשון לבחינת הבטיחות של התרכיב על 45 מתנדבים בריאים. הם יקבלו מינונים שונים של התרכיב ויחזרו ל-11 פגישות ביקורת במשך 14 חודשים כדי להעריך את הבטיחות של התרכיב ויכולתו לעורר תגובה חיסונית. מאחר שמדובר בניסוי קליני שלב 1, עדיין לא תיבדק יעילות החיסון נגד הדבקה. אם ניסוי זה יניב תוצאות חיוביות, החברה תוכל להמשיך לשלב קליני 2.
מבין החברות הנוספות שנמצאות בשלבי פיתוח טרום-קליניים אפשר למצוא גם את חברת Inovio Pharmaceuticals המובילה מאמץ של כמה חברות תרופות כדי להאיץ את הפיתוח של INO-4800, חיסון DNA כנגד הנגיף. החברה הכריזה כי סיימה את שלבי הפיתוח הטרום-קליניים ותתחיל בניסויים קליניים בבני אדם באפריל 2020.
חברת Clover Biopharmaceuticals מפתחת חיסון רקומביננטי נגד חלבון S אשר אחראי כאמור להיצמדות הנגיף לתאי המטרה וחדירתו לתוכם. החברה הצליחה לזהות נוגדנים נגד החלבון בדמם של חולים שהחלימו מהמחלה, כך שמדובר באנטיגן מבטיח ליצירת חיסון. היא החלה בייצור האנטיגן בתרביות תאים ושואפת לסיים פיתוח של התרכיב לניסויים טרום-קליניים תוך 6-8 שבועות.
8 צפייה בגלריה


ד"ר חן כץ, ד"ר נדיה גרוזדוב וד"ר אהוד שחר במעבדת מכון מיגל, בחזית המאבק נגד קורונה
(צילום: אפי שריר)
לאחר ארבע שנות מחקר ופיתוח, במכון מיגל הישראלי פיתחו חיסון למתן דרך הפה, IBV, נגד נגיפי קורונה בעופות. כעת החוקרים שוקדים על התאמת התרכיב לנגיף הקורונה החדש ולשימוש בבני אדם. החוקרים ציינו כי הם מקווים לסיים את השלבים הטרום-קליניים תוך שלושה חודשים.
גם לאחר מציאת אנטיגן מתאים, יש עוד שלבים רבים באופטימיזציה של תרכיב החיסון, בהם קביעת ריכוז האנטיגן, הרכב המלחים בתרכיב, צורך בהוספת אדג'ובנט, מספר מנות חיסון, פרקי הזמן שיש להמתין בין כל מנת חיסון ועוד. קביעת הפרמטרים הללו מצריכה בחינה מדוקדקת של התגובה החיסונית שנוצרת בעקבות מתן התרכיב, סוג התאים המופעלים, רמת הנוגדנים שנוצרים ויכולתם לזהות את הנגיף ולמנוע הדבקה ותחלואה.
לאחר השלמת הפיתוח הטרום-קליני, יהיה צורך בכל שלבי הניסוי הקליניים כדי להבטיח את בטיחות החיסון ויעילותו לכל סוגי אוכלוסיות היעד, הכוללים גם מדוכאי חיסון, ילדים, נשים הרות ועוד. למרות ששלב זה יכול להימשך מספר שנים, הודיע ראש ארגון הבריאות העולמי כי בזכות שילוב מרוכז של מאמצים והאצת הפיתוח הטרום-קליני, הוא מקווה שמשך הפיתוח יתקצר לכשנה וחצי.
גם לאחר אישור התרכיב, יש לקחת בחשבון את יכולות הייצור וההפצה. במידה שיהיה צורך להפיץ את החיסון לכלל אוכלוסיית העולם, במקרה של מגפה כלל-עולמית, כפי שארגון הבריאות העולמי הכריז על COVID-19, יכולת הייצור המרבית מספיקה לשתי מנות חיסון עבור כ-40 אחוז מכלל האוכלוסייה. אם החיסון שיוכיח עצמו כיעיל יהיה חיסון שמבוסס על RNA או DNA, יכולות הייצור פוחתות אף יותר שכן מדובר בטכנולוגיה חדשה יחסית וחסרות תשתיות ייצור לסוג כזה של תרכיב ברמה עולמית.
בנוסף, קיימת מגבלה משמעותית ביכולת ההפצה של התרכיב למדינות מתפתחות. לפיכך, אם הנגיף יתפשט באופן משמעותי למדינות אלה, המצב יהיה מאוד קשה לשליטה, גם אם יימצא חיסון יעיל.
ומה לגבי תרופה?
באופן כללי, מכיוון שנגיפים תוקפים את התא מבפנים, יש יחסית מעט תרופות נגד נגיפים, והטיפול המועדף הוא מניעת המחלה באמצעות חיסון. עם זאת, יש כמה תרופות שהוכיחו את עצמן נגד נגיפים מסוימים, וכמה מוסדות מחקר מנסים לפתח תרופות לטיפול בנגיף החדש, או להתאים נגדו תרופות אחרות.
המחקר האינטנסיבי של הנגיף החדש מצליח לשפוך אור על תהליכים החיוניים להדבקה והתרבות של הנגיף בתאים, דבר המקדם מאוד גם מציאת טיפולים יעילים נגד הנגיף.
מציאת מנגנון הכניסה של הנגיף לתאים באמצעות חלבון S מאפשר לבצע סריקות למציאת מולקולות קטנות או תרופות קיימות שיכולות להפריע לכניסת הנגיף לתא. כך למשל, חברת APEIRON Biologics בוחנת יעילות של מולקולה קטנה בשם APN01 החוסמת את הקולטן של התאים שאליו נקשר חלבון S ובכך מונעת הדבקה. כרגע התרופה החדשה נבדקת בניסוי קליני שלב 1 לבטיחות ויעילות.
לאחר שהנגיף חודר לתאי האפיתל של דרכי הנשימה, הוא מתבסס על פעילות של שני חלבונים חיוניים כדי להתרבות ולבסס הדבקה.
הראשון הוא אנזים שנקרא RNA-dependent RNA polymerase אשר אחראי לשכפול של הנגיף. זהו חלבון ייחודי של הנגיף אשר אינו קיים בתאי אדם ולכן יכול לשמש מטרה לפיתוח של תרופה. מאחר שרצף הגנום של הנגיף כבר ידוע לנו, אפשר לייצר את החלבון ולחפש חומרים פוגעים בפעילותו, או לחילופין להשתמש בתוכנות שינסו למצוא מולקולות שיכולות לעכב את פעילותו על בסיס ידיעת המבנה והתכונות שלו.
גם החלבון השני הוא אנזים, והוא אחראי על עיבוד חלבוני הנגיף בתא המודבק. גם הוא חלבון ייחודי של הנגיף, שאינו קיים באופן טבעי בתאי אדם, ולכן יכול להוות מטרה לפיתוח של תרופה. בזכות מאמצים מרוכזים, המבנה של האנזים הנגיפי פוענח לאחרונה וכעת מספר קבוצות מנסות למצוא תרופות שמסוגלות לעכב אותו.
תרופה אפשרית נוספת הנמצאת בשלבי פיתוח היא remdesivir של חברת Gilead Sciences. התרופה היא נוקלאוטיד פגום, כלומר אחת מאבני הבניין של ה-RNA הנגיפי, שעוצבה כך ש"תתקע" את ייצור החומר הגנטי של הנגיף ותעכב את התרבותו בתאים. התרופה פותחה במקור לטיפול באבולה, אך לא הראתה יעילות בניסויים קליניים. כעת, מנסים לבחון אם התרופה יכולה להועיל במקרים של הדבקה בקורונה.
בדומה לשלבים הרגולטוריים ההנחוצים לאישור חיסון, גם מציאת תרופה חדשה מצריכה שלבי פיתוח ובחינה רבים וארוכים. הניסיונות להשתמש נגד הקורונה בתרופות אנטי-נגיפיות קיימות שפותחו נגד HIV או שפעת מנסים להתגבר על כך, אך הגישה הזו אינה מבטיחה הצלחה.