1. פענוח מבנה הריבוזום
השנה: 2000
במשך עשורים ניסו מדענים להבין את אופן תפקודו של הריבוזום – מולקולה שהינה קריטית לתפקוד התא. מולקולת הריבוזום מורכבת מ־RNA ומאנזימים שונים, ותפקידה לתרגם את הקוד הגנטי לחלבונים. תפקיד מרכזי זה הופך את הריבוזום לבעל חשיבות עצומה, שכן כל פגיעה בו משביתה את התא. הבנת הדרך שבה הוא מייצר חלבונים יכולה לשפוך אור על הקשר שבין פגמים שונים שנוצרים בחלבונים ובין הופעת מחלות שונות. ואולם כדי להבין את תפקוד הריבוזום היה צורך תחילה לפענח את מבנהו – דבר שאיש לא הצליח לעשות בעבר.
במשך שנים רבות השיטה היחידה לפענוח המבנה המרחבי של מולקולות ביולוגיות הייתה באמצעות קריסטלוגרפיה, שיטה שבה יוצרים מהמולקולות גביש, ועל ידי הקרנתו בקרינת רנטגן חזקה אפשר לגלות את מבנהו לפי פיזור הקרניים. אלא שבניגוד למולקולות הביולוגיות הקטנות יחסית שניתן לגבשן בקלות, הריבוזום הוא מולקולה גדולה יותר ומורכבת, בלתי יציבה ונוטה להתפרק כשהיא נחשפת לקרינה. לכן גיבושו נחשב למשימה בלתי אפשרית.
אלא שלמרות הסקפטיות של הקהילה המדעית, פרופ' עדה יונת ממכון ויצמן למדע החליטה להתמקד בחקר הריבוזום. היא פיתחה שיטה מקורית שבה טבלה את גבישי הריבוזומים בשמן ואז הקפיאה אותם במהירות באמצעות חנקן נוזלי – וכך הצליחה להקרינם. הודות לשיטה זו היא הצליחה לפענח את מבנה הריבוזום, ובשנים 2000 ו־2001 פרסמה עם סטודנטים שלה סדרת מאמרים המציגים את המבנה והתפקודים שלו. תשע שנים מאוחר יותר, ב־2009, זכתה פרופ' יונת בפרס נובל בכימיה על פענוח מבנה הריבוזום וחקר תפקודיו השונים, שאותו קיבלה במשותף עם שני מדענים אחרים, ונקטרמן רמאקרישנן ותומס סטייץ’.

חשיבות הגילוי: הבנת מבנה הריבוזום פותחת את הדלת להבנת מחלות ובעיות בתפקוד התאים. כמו כן, פענוח מבנה הריבוזום מאפשר לייעל טיפולים אנטיביוטיים ולפתח תרופות חדשות שנקשרות ביעילות רבה יותר לאתרים שונים בריבוזום ומשתקות את ייצור החלבונים של החיידק. ואכן, לאחר גילוי הריבוזום החלה פרופ' יונת לחקור דרכים לשיפור אנטיביוטיקות הנקשרות לריבוזום של חיידקים. השיטה שפיתחה, שמכונה קריו־ביו קריסטלוגרפיה, משמשת כיום לקביעת המבנה של חומרים ביולוגיים רבים.
2. המקצבים היממתיים מושפעים מהעולם החיצוני
השנה: 2001
השעון הביולוגי הוא מבנה מוחי הבנוי מ־20 אלף תאי עצב שנקראים הגרעינים העל־כיאזמטים (SCN) וממוקמים בהיפותלמוס, ממש מעל לאזור שבו מצטלבים עצבי הראייה שלנו. המנגנון המולקולרי של המבנה הזה כבר זוהה לפני שנים רבות, אך הדרך שבה הוא פועל ומניע את המקצבים הצירקדיאניים (יממתיים), כמו טמפרטורת הגוף, מחזורי השינה־ערות והפרשת הורמונים מסוימים, לא הייתה ברורה עד תחילת המילניום.
במחקר שפורסם ב־2001 בכתב העת Science בחנו חוקרים מבית הספר לרפואה באוניברסיטת הרווארד מקבץ זעיר של תאי עצב מאחורי העין, וגילו מסלול המעורב בדרך שבה השעון הביולוגי של המוח שולח אותות השולטים במקצבים היממתיים של הגוף. הם מצאו שחלבון בשם TGF-alpha, הפועל בתיווך של חלבון אחר (קולטן EGF), מווסת את דגמי הפעילות הפיזית היומיים וגם את דגמי השינה־ערות. אבל ההפתעה האמיתית הייתה הגילוי שה־TGF-alpha, בתיווך קולטן ה־EGF, מקבל מידע לא רק מהשעון הביולוגי, אלא גם מהעיניים.

במילים אחרות, המקצבים הצירקדיאניים נשלטים אמנם על ידי השעון הביולוגי, אך מושפעים גם מהעולם החיצוני, בייחוד מהאור, שמועבר דרך הרשתית. גירוי קרני האור נקלט ברשתית העין ומשם מועבר כאות עצבי אל השעון הביולוגי ב־SCN, וזה מעבד את האותות ושולח את המידע אל השעונים השוכנים בתאים של יתר הרקמות ואיברי הגוף.
חשיבות הגילוי: לתהליך המורכב שבו פועל השעון הביולוגי שלנו ולדרכים שבהן הוא נמצא באינטראקציה עם הסביבה יש השפעות מרחיקות לכת על בריאותנו הפיזית והנפשית. מחקרים שהצטברו מאז מצביעים על כך שבאמצעות כרונותרפיה - תזמון הטיפולים הרפואיים ואף התזונה ואורח החיים בכלל על פי השעון הביולוגי של הגוף - ניתן לשפר משמעותית את הטיפול הרפואי, את הבריאות ואת איכות החיים, וכל תחום המדע הזה נמצא כעת בעיצומו.
3. CRP מהווה מדד טוב יותר לחיזוי היארעות התקף לב מאשר LDL
השנה: 2002
CRP הוא חלבון הנוצר בכבד ומופרש לזרם הדם. רמתו בדם עולה כתוצאה מתהליכים דלקתיים וזיהומיים כבר בתוך שעות לאחר התחלת התהליך הדלקתי בגוף, והיא מגיעה לשיאה כעבור 48־72 שעות. למעשה, העלייה ברמות ה־CRP קודמת לעתים תכופות להופעת תסמינים מובהקים של הדלקת, כמו חום, כאבים וכדומה.
ב־2002 גילה צוות חוקרים בראשותו של ד"ר פול רידקר מבית החולים Brigham and Women’s שהחלבון CRP אף מנבא את הסיכון ללקות בהתקף לב. במחקר, שפורסם בכתב העת New England Journal of Medicine, השוו ד"ר רידקר ועמיתיו את יכולת הניבוי של רמת ה־CRP ושל LDL (הכולסטרול ה"רע") להתקף לב ראשון בעתיד. מחקרם כלל מדגם של כ־28 אלף נשים ללא תסמינים קליניים בגילאי 45 ואילך. בתחילת המחקר ערכו החוקרים בדיקות דם לכל המשתתפות ובחנו את ה־CRP וה־LDL שלהן. לאחר מכן הם עקבו אחר מצב בריאותן במשך שמונה שנים ותיעדו אירועי לב או כלי דם, כמו אוטם שריר הלב, שבץ מוחי וכן מוות כתוצאה מהתקף לב.
למרבה ההפתעה, התברר שה־CRP מנבא טוב יותר את ההיארעות של אירועי לב וכלי דם חריפים או אף קטלניים מאשר ה־LDL. נמצא כי בקרב הנשים שאצלן נמדדה רמה גבוהה של CRP בדם התרחשו אירועים משמעותיים במובהקות גדולה יותר מאשר בנשים שאצלן ערכי ה־CRP בדם היו תקינים. בו זמנית נמצא שערכו של כולסטרול LDL כמנבא התקפי לב ושבץ היה צנוע יותר.
חשיבות הגילוי: הגילוי הזה הוביל להכללה של בדיקת CRP כמדד לניבוי מחלות לב וכלי דם לצד מדדי כולסטרול, וסביר להניח שעד כה הצליח להציל לא מעט חיים.
4. המקור לרעלת היריון
השנה: 2003
רעלת היריון מתרחשת בכ־5% מההריונות ומאופיינת בעלייה בלחץ הדם, בהפרשה מוגברת של חלבון בשתן ובבצקות קשות. בהיריון רגיל העובר המתפתח מאותת לגוף האם להרחיב את כלי הדם לשליה, המספקת לו חמצן וחומרים מזינים. אך מסיבות שלא היו ידועות, אצל נשים עם רעלת היריון כלי הדם הולכים ונעשים צרים יותר, מה שמפריע לזרימת הדם והחמצן ומוביל לסיבוכים, בהם לעתים גם פגיעה באיברים ובמערכות של האם, שעלולים להיות קטלניים לה ולעובר שבבטנה.

במחקר שפורסם ב־2003 בכתב העת Journal of Clinical Investigation הצביעו חוקרים מהמרכז הרפואי בית ישראל דיאקונס (BIDMC) על המקור של הסיבוך מסכן החיים הזה. החוקרים השתמשו בבדיקות לביטוי הפרופיל הגנטי של רקמת השליה מנשים עם וללא רעלת היריון, ומצאו שרמותיו של חלבון בשם sFlt1 המופרש מהשליה היו מוגברות משמעותית בקרב נשים עם רעלת היריון. כדי לבדוק אם אכן החלבון הזה הוא שורש הבעיה, הם העבירו את החלבון לחולדות הרות ולא הרות. ואכן, הם מצאו שלחולדות שנחשפו ל־sFlt1 היו תסמינים קליניים ופתולוגיים מובהקים של רעלת היריון – ממצא שהדגים לראשונה קשר ברור ותוצאה בין חלבון זה ובין המחלה.
החלבון הזה נקשר לקבוצה אחרת של חלבונים שמכונה "גורמים אנגיוגניים" וגורם לנטרולה. תפקידם של גורמים אלה, בהם גורם צמיחת אנדותל כלי דם (VEGF) וגורם צמיחת שליה (PIGF), הוא לקדם היווצרות כלי דם חדשים. נטרול של חלבונים אלה משפיע על בריאות כלי הדם הקטנים של האם, ובסופו של דבר מוביל לתסמינים המצביעים על רעלת היריון.
חשיבות הגילוי: פיתוח אסטרטגיות לטיפול ברעלת היריון, וכן פיתוח טיפולים אנטי־אנגיוגניים לסרטן, שכן הגורמים האנגיוגניים ממלאים תפקיד חשוב גם בעידוד הצמיחה של גידולים בחולי סרטן.
5. מתג מולקולרי שמפעיל את ההתפתחות של תאי שומן חום
השנה: 2007
בגופנו יש שני סוגים עיקריים של שומן: חום ולבן. השומן הלבן הוא זה שקשור להשמנה, שכן תאי השומן הלבנים אוגרים את עודפי האנרגיה לשימוש מאוחר יותר. במצב של השמנה, ובעיקר השמנה בטנית, מתרבה השומן הלבן והופך עם הזמן לדלקתי. החומרים הדלקתיים בשומן זה בולמים את מנגנון שריפת האנרגיה, כך שהגוף שורף פחות שומן, והתוצאה היא תהליך שבו מחמירה ההשמנה.
השומן החום, לעומת זאת, מתנהג יותר כשריר מאשר כשומן. לתאי השומן החום יש קצב חילוף חומרים גבוה והם שורפים אנרגיה במקום לאגור אותה, ולכן מונעים השמנה. בעבר סברו המדענים שרק לתינוקות יש שומן חום, שנועד לספק להם חום ולהגן עליהם מהקור, ושמאגרי השומן החום נעלמים לאחר גיל הינקות ואצל אנשים בוגרים מאגרי השומן עשויים אך ורק מתאי שומן לבנים. ואולם בעשור האחרון הראו מחקרים שגם לבני אדם בוגרים יש רקמת שומן חום.

ב־2007 זיהו חוקרים מהמכון לסרטן דנה פרבר בבוסטון, מסצ'וסטס, בראשות ד"ר ברוס שפיגלמן, חלבון הפועל כמעין מתג מולקולרי שמפעיל את ייצור תאי השומן החום המועילים, וגורם לתאי שומן להפוך לחומים ולא ללבנים. במחקר, שנערך בעכברים, מצאו החוקרים שתאי השומן החום מכילים כמויות גדולות של חלבון שנקרא PRDM16, שהינו נדיר בתאי שומן לבנים ובתאים אחרים כמו תאי השרירים והכבד. כשהחוקרים הנדסו גנטית תאי שומן בעכברים כדי לבטא את החלבון PRDM16, הפכו התאים לתאי שומן חומים ולא לבנים, וכאשר הגן לחלבון זה הוסר מתאי שומן חומים, הפסיקו התאים להיות תחנות כוח מטבוליות. ממצאי המחקר פורסמו בכתב העת Cell Metabolism.
חשיבות הגילוי: פיתוח אסטרטגיות שונות, הקשורות הן לאורח החיים והן לטיפולים תרופתיים, שיעזרו להפעיל את החלבון PRDM16 כדי לעודד הוצאת אנרגיה ולמנוע השמנת יתר. ואכן, מחקרים שנערכו בהמשך הראו למשל שפעילות גופנית מפעילה את המתג המולקולרי הזה.
6. דפוסי מחשבה שליליים מקצרים את הטלומרים
השנה: 2009
הטלומרים הם מולקולות ייחודיות שנמצאות בקצהו של כל אחד מ־23 הכרומוזומים שלנו. מולקולת הטלומר יוצרת מעין "כובעון" בקצה הכרומוזום השומר על החומר הגנטי מפירוק. בכל פעם שהתאים מתחלקים לשניים, הטלומרים מתקצרים מעט, עד שהם כבר נעשים קצרים מדי, ובשלב זה התא אינו יכול עוד להתחלק.
המשמעות היא שלטלומרים יש חשיבות עצומה בקביעת קצב ההזדקנות שלנו, שכן כמות הפעמים שתאי הגוף שלנו יכולים להתחלק תלויה באורכם. ואכן, מחקרים מראים שאורך הטלומרים מנבא באופן מהימן התפרצות מוקדמת של מחלות הקשורות להזדקנות ולתמותה מוקדמת.
מגוון גורמים, בהם תזונה ופעילות גופנית, משפיעים על המהירות שבה יתקצרו הטלומרים שלנו, ומכאן - עד כמה מהר נזדקן ונחלה. אך מתברר שגם לדפוסי החשיבה שלנו יש השפעה על הטלומרים ועל המהירות שבה הם מתקצרים.
הגילוי הזה שייך לפרופ' אליזבת בלקבורן, ביולוגית מאוניברסיטת קליפורניה, ופרופ' אליסה אפל, פסיכולוגית העומדת בראש המעבדה להזדקנות, מטבוליזם ורגשות שאף היא מאוניברסיטת קליפורניה. במחקר שפרסמו השתיים ב־2009 בכתב העת Brain, Behavior, and Immunity, הן מצאו שנשים בעלות דירוג גבוה של פסימיות היו גם בעלות טלומרים קצרים יותר. בהמשך הן גילו שגם לדפוסי חשיבה שליליים אחרים, כמו מרמור, עוינות והרהורים חוזרים על בעיות ועל חוויות שליליות, יש השפעה שלילית על הטלומרים שלנו.
חשיבות הגילוי: מאחר שקיצור הטלומרים של התאים קשור לסיכון מוגבר לתחלואה הקשורה לגיל ולתמותה מוקדמת, הגילוי יכול להצביע על מנגנון פיזיולוגי שלא היה מוכר עד כה, העומד בבסיס ההשפעות המזיקות של תחושות עוינות וכעס על הבריאות שלנו. לכן, לדברי החוקרות, חשוב להיות מודעים וקשובים להלך המחשבה שלנו ולנסות ליישם טכניקות גוף־נפש וכלים שיסייעו לנו לווסת מחשבות ורגשות שליליים וכך לשפר את בריאות הטלומרים.
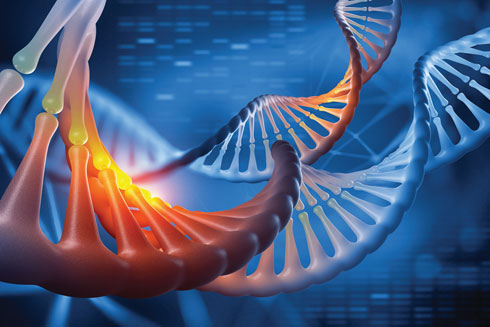
7. קריספר – מערכת ביולוגית לעריכת גנים
השנה: 2015
קריספר (CRISPR/Cas9) היא מערכת ביולוגית סינתטית המאפשרת "לערוך" גנים באמצעות חיתוך והוצאה של מקטע DNA פגום מהגנום והחלפתו במקטע תקין. המערכת מבוססת על מנגנון שהתגלה בחיידקים, ואשר מגן עליהם מפני נגיפים באמצעות "חיתוך" ה־DNA של הנגיף. כשהתא החיידקי מזהה פלישה של נגיף, הוא מייצר אנזים בשם Cas9 שמצליח לגזור את רצף ה־DNA של הנגיף ובכך לנטרל אותו.
ב־2012 גילו לראשונה הביוכימאיות פרופ' ג'ניפר דאודנה מאוניברסיטת קליפורניה, ופרופ' עמנואל שרפנטייה, ראש מכון מקס פלאנק לפתוגנים, את המנגנון המולקולרי הזה, והראו את השימוש במערכת הקריספר לחיתוך DNA מחוץ לחיידק. מחקרן פורסם בכתב העת Science והוביל לפריחה מחקרית עצומה בתחום. בהמשך, ב־2013, הראה החוקר הסיני פנג ז'נג לראשונה את השימוש בקריספר בהנדסה גנטית בתאי עכבר ואדם, ומאז המערכת משמשת לצורך הנדסה גנטית ועריכת גנים, כולל הוספה, שינוי או הקטנת הביטוי של גנים.
ב־2015 כבר דיווח צוות חוקרים סינים בכתב העת Protein & Cell שהם הצליחו לראשונה לערוך את הגנום של עוברים אנושיים ולשנות את ה־DNA שלהם. החוקרים השתמשו בטכנולוגיה כדי לתקן מוטציה בגֵן האחראי לבתא־תלסמיה (מחלת דם שעלולה להיות קטלנית). הניסוי בוצע בעובר בן תא אחד, ומסיבות אתיות השתמשו רק בעוברים שנמצאו כבלתי תקינים, אך לא הוכתר בהצלחה (המוטציה תוקנה רק בחלק קטן מהעוברים, ובחלקם נגרמו מוטציות בגנים אחרים). ואולם ב־2019 הכריז המדען הסיני הא ג'יאנקוי בסרטון וידאו שערורייתי על לידתן של התאומות ננה ולולו – התינוקות הראשונים אי פעם שנוצרו בהנדסה גנטית כשהיו ביציות מופרות. ג'יאנקוי השתמש במערכת קריספר כדי לערוך את הגנים של התאומות ולהסיר חלק מהגֵן CCR5 – גן האחראי ליצירת חלבון שבו משתמשים כמה מזני נגיף ה־HIV האלימים כדי לחדור לתאי מערכת החיסון - זאת כדי להקנות לגנים שלהן עמידות לנגיף שאביהן היה חיובי אליו, וכך להגן עליהן מפני הידבקות.
חשיבות הגילוי: היישומים הפוטנציאליים של הקריספר כמעט בלתי מוגבלים: לרפא מחלות סרטן ומחלות גנטיות, ואולי אף למנוע אותן באמצעות עריכת הגנים עוד לפני הלידה. אף על פי כן הטכנולוגיה מצויה בלבו של דיון מדעי סוער. חלק מהחוקרים מזהירים שמדובר במדרון חלקלק וקוראים לפיקוח גלובלי על הטכנולוגיה בשל חששות אתיים ובטיחותיים, שכן היא עלולה להתפתח כך שתאפשר לשלוט בתכונות ספציפיות שמועברות בתורשה על ידי עריכת גנים בעובר האנושי - ולהוביל לתרחיש "פרנקנשטיין" שבו התעסקות עם כמה גנים כדי ליצור את "התינוק הרצוי" תוביל להשלכות גנטיות בלתי הפיכות.
8. מדוע הגידול הסרטני חוזר לאחר טיפול שהוכתר בהצלחה
השנה: 2017
למרות התפתחויות מרשימות בתחום רפואת הסרטן, כולל רפואה מותאמת אישית, אימונותרפיה ופיתוח טכנולוגיות הדמיה מתוחכמות, התעלומה הגדולה שיותר ויותר מחקרים מנסים לענות עליה בשנים האחרונות היא מדוע במקרים רבים כל כך הגידול הסרטני חוזר אחרי הטיפול, גם כאשר לכאורה הוא מוכתר בהצלחה.
ביולי 2017 פורסם בכתב העת Science Translational Medicine מחקר השופך אור על התעלומה. החוקרים, בראשות פרופ' ג'ורג' קאראגיאניס מקולג' אלברט איינשטיין לרפואה בישיבה יוניברסיטי בניו יורק, מצאו שאף כי בטווח הקצר הטיפול הכימותרפי מכווץ את הגידולים הסרטניים, הרי שהוא עצמו יכול למעשה לגרום להתפשטות הגידולים ולהפיכתם לקטלניים. תוך שימוש באמצעי הדמיה מתוחכמים בחנו החוקרים את ההשפעות של תרופות כימותרפיות ניאו־אדג'ובנטיות (תרופות כימותרפיות הניתנות לפני הניתוח להסרת הגידול במטרה להקטינו) בעכברים עם סרטן שד ובעכברים שהושתלו בהם רקמות סרטן שד שנלקחו מחולות אנושיות, וכן ב־20 נשים החולות בסרטן השד. הם גילו שהכימותרפיה גורמת להיווצרות גרורות על ידי כך שהיא פותחת מעין "כניסות" בכלי הדם, וכך מאפשרת לתאי הסרטן להתפזר במערכת הדם ולהתפשט מהגידול המקורי לאתרים אחרים בגוף.
מחקרים קודמים הראו שבמצב של גידולים סרטניים כלי הדם חדירים באופן חריג. חדירות זו מאפשרת לתאים מהגידול הראשוני לפלוש לתוכם, וכך הם נסחפים דרך מחזור הדם לאיברים אחרים בגוף ויוצרים שם גידול משני – גרורה. אבל מה בדיוק גורם לחדירות זו וכיצד נוצרות ה"כניסות" בכלי הדם? במחקר הנוכחי גילו החוקרים שהכימותרפיה מגדילה את מספר ה"כניסות" האלה ואת צפיפותן, וכן את הביטוי של חלבון בשם MENA, המעודד את יכולתו של התא הסרטני לפלוש ומעודד התפשטות גרורות. יתר על כן, הם מצאו שבחולות שקיבלו טיפול כימותרפי טרום ניתוחי אגרסיבי יותר - הן מספר ה"כניסות" וצפיפותן והן הביטוי של חלבון ה־MENA היו מוגברים במיוחד.
מחקר זה מצטרף לשורת מחקרים בנושא זה משנים קודמות, שהראשון בהם נערך בישראל בראשות פרופ' יובל שקד מהפקולטה לרפואה בטכניון. מחקרים אלה כבר הצביעו על כך שהטיפולים נגד סרטן – בהם לא רק כימותרפיה, אלא גם הקרנות, ניתוחים, ואפילו טיפולים ביולוגיים סלקטיביים וממוקדי מטרה - משפיעים על סביבת הגידול בדרך שבאופן מובנה עלולה לגרום לחזרת הגידול ולהיווצרות גרורות. בנוסף להגברת החדירות של כלי הדם השפעה זו מתרחשת במנגנון חשוב אחר – על ידי הפעלת מנגנוני התיקון של הגוף כנגד הנזק שנוצר בגידול ובסביבתו. מנגנון זה גורם לתאים הסרטניים שלא חוסלו בטיפול להתרבות ולשגשג.
חשיבות הגילוי: הממצאים מצביעים על חשיבות המשך המחקר בתחום, ועל הצורך בשיפור יעילות הכימותרפיה, כמו גם בפיתוח טיפולים אישיים יותר, שיתבססו לא רק על בחינת אפיוני הגידול כפי שנעשה כיום ברפואה מותאמת אישית, אלא גם מבחינת הסביבה הגידולית. בנוסף, גילוי המנגנונים עשוי להוביל לפיתוח תרופות שיחסמו את מנגנוני תיקון הנזק וינטרלו את הפעילות של חלבונים מזיקים כמו ה־MENA, וכך ישפרו את יעילות הטיפולים האנטי סרטניים ויגבירו את יעילותם.
9. תקציב האנרגיה של המוח קבוע ומוגבל (וזו הסיבה ל"עיוורון התפיסתי" הגורם לתאונות)
השנה: 2020
מחקרים רבים הראו בעבר שלמוח שלנו יש קיבולת מוגבלת, עובדה שהינה בולטת במיוחד במצבים של עומס גבוה, שבהם אנו חווים עיוורון (או חירשות) תפיסתי זמני. במצב זה אותות אזהרה חשובים אינם מגיעים למוח למרות שהחושים קולטים אותם. לאחרונה, צוות חוקרים בראשות פרופ' נילי לביא מיוניברסיטי קולג' בלונדון גילה את הסיבה לתופעה.
החוקרים עקבו באמצעות שיטה לא פולשנית אחר רמותיו של החומר ציטוכרום C אוקסידאז (OxCCO) במוחם של נשים וגברים. OxCCO הוא סמן מטבולי המשתתף בתהליך חילוף החומרים בתאי העצב בקליפת המוח – האזור שבו מתבצע העיבוד החזותי. זאת תוך שהמשתתפים ביצעו משימת חיפוש חזותית רציפה מהירה בתנאים של עומס תפיסתי גבוה, או לחלופין: בתנאי עומס נמוך.
ממצאי המחקר, שפורסם באוגוסט האחרון בכתב העת Journal of Neuroscience, הראו שבמשימות שדרשו עומס תפיסתי גבוה, רמות ה־OxCCO באזורי קליפת המוח החזותית עלו, אך במקביל באזורים המבצעים עיבוד ללא השגחה פחתו הרמות משמעותית. לדברי החוקרים, ממצאים אלה מעידים על קיומו של מנגנון פיצוי קשב המסדיר את רמות חילוף החומרים בהתאם לדרישות העיבוד, ומצביעים על כך שרמות המטבוליזם הכללי של המוח נותרות קבועות ללא קשר לרמות העומסים.
במילים אחרות, האנרגיה שהמוח מקבל היא מוגבלת. למרות שכמות גדולה מכלל האנרגיה המטבולית של הגוף מופנית למוח, אין לו אפשרות להעלות את צריכתה כשהוא נדרש למשימות מנטליות מורכבות, ולכן הוא חייב לעשות טרייד־אוף של הקשב - אם משימה כלשהי דורשת יכולת חישוב גבוהה יחסית, לא נשארת מספיק קיבולת למשימות אחרות.
חשיבות הגילוי: לגילוי יש השלכות חשובות על מניעת תאונות ואף טעויות בניתוחים ובמשימות קריטיות אחרות, שכן הוא מסביר מדוע אנשים אינם רואים למשל מכונית המתקרבת אליהם, כאשר הקשב שלהם מופנה למשהו אחר. למרות שהעין רואה את המכונית, המוח אינו יכול לעבד את המידע החזותי הזה משום שלא נותרה מספיק אנרגיה לנוירונים שאמורים להגיב למידע.
10. מרכיבים חדשים בצמח הקנביס שעשויים להיות חזקים פי 30 מה־THC
השנה: 2020
THC, טטרה הידרוקנבינול, הוא החומר הפעיל העיקרי בקנביס. החומר הזה, שהתגלה וסונתז על ידי פרופ' רפאל משולם כבר ב־1964, הוא חומר פסיכו־אקטיבי שאחראי לתגובת ההיי של הצמח, אך במקביל הוא גם בעל השפעות חיוביות, כגון הקלה על הקאות ובחילות, פעילות נוגדת דלקת וכאב ועוד. במחקריו של פרופ' משולם התברר שה־THC מתקשר לשני סוגי קולטנים הקיימים במוח ובגוף, שנקראים CB1 ו־CB2, שהם מעין "קנבינואידים עצמיים", ושלהם תפקידים פיזיולוגיים רבים ברבות ממערכות הגוף. בניגוד ל־THC, הקנבינואיד המרכזי הנוסף שהתגלה, CBD, הוא בעל פעילות אנטי פסיכוטית, הסותרת ומפחיתה חלק מתופעות הלוואי של ה־THC, ולכן משמש לטיפול רפואי בחרדה ובבעיות אחרות. בנוסף הוא בעל פעילות נוגדת דלקתית ומשפיע על הטונוס השרירי ועל תחושת הכאב. גילויים אלה הובילו חוקרים, וגם את תעשיית התרופות, לנסות לייצר חומרים סינתטיים שיתחברו לקולטנים שהתגלו, ויסייעו בפתרון מחלות ובעיות בריאות שונות.
אלא שלאחרונה גילו מדענים מאיטליה מרכיב חדש בצמח הקנביס שטרם היה ידוע למדע. החומר, שנקרא THCP (טטרהידרוקנביפורול), הוא בעל מבנה דומה לזה של ה־THC, אך פעיל ממנו ביותר מפי 30. החוקרים בודדו את החומר ואפיינו את המבנה הכימי שלו, ומצאו שהוא נקשר בזיקה גבוהה לקולטני CB1 ו־CB2 אנושיים. במחקר בעכברים נמצא שהוא גורם להאטה בתנועה, לשיכוך כאבים ולהורדת חום - תוצאות המאפיינות את פעילות ה־THC. ואולם נמצא כי ה־THCP היה פעיל פי 33 יותר מה־THC המוכר, ופי 63 יותר פעיל מ־THCV - חומר פעיל נוסף בקנביס. בנוסף בודדו החוקרים ואפיינו חומר נוסף, CBDP (קנבידיפורול), שנראה כי הוא קשור ל־CBD.

במחקר השתמשו החוקרים בזן קנביס רפואי איטלקי שנקרא FM2. לדבריהם, סביר להניח שזני קנביס אחרים עשויים להכיל אחוזים גבוהים אפילו יותר של THCP. הגילויים האלה פורסמו בפברואר השנה בכתב העת Nature.
חשיבות הגילוי: החוקרים מעלים את ההשערה שהחומר החדש שהתגלה יכול להסביר את ההשפעה העוצמתית של חלק מזני המריחואנה שמכילים ריכוז נמוך של THC, ולשפוך אור על כמה השפעות פרמקולוגיות של הקנביס, שלא ניתן לייחס אך ורק ל־THC, זאת בזכות היכולת החזקה של ה־THCP להיקשר לקולטנים בגוף האדם. לדבריהם, יש לכלול תרכובת זו ברשימת הפיטו־קנבינואידים העיקריים שייקבעו לצורך הערכה נכונה של ההשפעה הפרמקולוגית של תמציות הקנביס הניתנות כיום לחולים.
*הכותבת היא בעלת דוקטורט (.Phd) בתקשורת בריאות וחוקרת באוניברסיטת חיפה