נא להכיר: 4 מדענים ישראלים שהעולם מצדיע להם
במציאות של דוגמניות וכוכבי אינסטנט, כמעט שכחנו שיש גם גיבורי תרבות אחרים. 4 מדענים ורופאים ישראלים זכו השנה בפרסים ובהכרה עולמית. הוצאנו אותם מהמעבדות והבנו למה
מחזיר חיוכים קודמים
ד”ר אייל גור נבחר על־ידי המגזין "ניוזוויק" כאחד הרופאים הטובים בעולם בתחום המיקרוכירורגיה
גיל ומצב משפחתי: 47, נשוי+ 3.
מגורים: תל אביב.
קריירה: למד רפואה באוניברסיטת תל אביב. את ההתמחות בכירורגיה פלסטית עשה במרכז הרפואי בתל אביב (איכילוב), ולאחר מכן התמחה בקנדה במיקרוכירורגיה. כיום עומד בראש המחלקה למיקרוכירורגיה באיכילוב.
הזכייה: המגזין "ניוזוויק", השני בתפוצתו בארצות הברית אחרי מגזין "טיים", מפרסם מדי שנה רשימה של עשר מחלקות רפואיות בעולם שמקבלות את התואר "מרכז מצוינות". מדובר במחלקות שמושכות אליהן חולים מכל העולם.
מאחורי המיקרוסקופ: ”אחד התחומים הייחודיים שבהם מתמקדת היחידה שלי הוא ניתוחים של גידולי עצם. עד לפני כמה שנים, במקרה של גידול סרטני בעצם היה צורך לקטוע את הרגל או היד. כיום המיקרוכירורגיה מאפשרת לנו לכרות אך ורק את הקטע הנגוע ולהחליפו בעצם שאותה נוטלים ממקום אחר בגוף, שבו אפשר לוותר עליה.
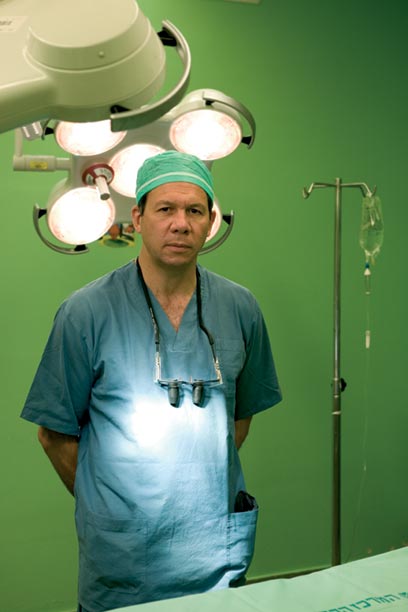
ד"ר אייל גור. חוד החנית של החדשנות והתחכום (צילום: ינאי יחיאל)
אבל התחום שאני גאה בו במיוחד, הוא הניתוחים להחזרת התנועה אצל אנשים שסובלים משיתוק בפנים, כתוצאה מבעיה מולדת, גידול, זיהום ויראלי שפוגע בעצב או פציעה. מעבר לבעיה האסתטית יש לחולים גם בעיה תפקודית. הם מתקשים לחייך, ולעתים גם לאכול ולדבר בבירור. הטיפול מצריך שני ניתוחים. בשלב הראשון נוטלים עצב תחושתי מהשוק, מחברים אותו לעצב הפנים בצד הבריא, כשהוא משמש כמעין ’כבל חשמלי מאריך’, ומשחילים אותו מתחת לעור אל הלחי המשותקת. כעבור כחצי שנה, לאחר שעצב הפנים הבריא צמח לתוך שתל העצב המושתל והגיע לצד המשותק, מבצעים ניתוח נוסף, שבו מעבירים לצד המשותק שריר קטן מהירך, ומחברים את כלי הדם והעצב שלו לקצה שתל העצב שצמח מהצד הבריא. כעבור חצי שנה נוספת, כשהאדם מחייך בצד הבריא, הזרם החשמלי שיוצא מהעצב בצד הזה, מפעיל גם את הצד המשותק. בעיניי זהו חוד החנית של החדשנות והתחכום בתחום המיקרוכירורגיה.
”הניתוח הראשון לשחזור החיוך שביצעתי היה בילד בן תשע שסבל ממום מולד בפניו, שמנע ממנו להניע את פניו ולחייך. חצי שנה לאחר הניתוח הוא הגיע למשרד שלי וחייך בפעם הראשונה. מבחינתי זו הייתה אחת מנקודות השיא החשובות בעבודה. לרוב, כירורגיה פלסטית היא מקצוע שמתגמל באופן מיידי. בסוף הניתוח אתה רואה את התוצאות מיד. אבל בניתוחי שחזור צריך להמתין חודשים עד שרואים תוצאות, וכשילד מחייך בזכותך בפעם הראשונה בחייו, זו הרגשה שקשה לתאר”.
לתפארת מדינת ישראל: זה התחיל מסיפור אנושי פשוט שהתגלגל למגזין "ניוזוויק", סיפורו של אחמד פקהורי, צעיר פלשתיני שנפצע קשה בתאונת דרכים בג’נין. במהלך התנגשות בין שתי מכוניות עף רסיס ממגן הרוח של אחת המכוניות וחתך את הצד השמאלי של פניו כשהוא קוטע עורקים חיוניים וגורם לשיתוק בשרירי הפנים בצד שמאל. במשך שעות עמל ד”ר אייל גור על הניתוח המורכב בפניו של הפצוע. הניתוח הצליח. שנה לאחר הפציעה הקשה פקהורי יכול לשלוט על שרירי פניו ולעשות משהו שלא יכול היה לעשות מאז התאונה: לחייך. הסיפור על הרופא הישראלי שהצליח להחזיר את החיוך לפניו של פלשתיני צעיר, נגע ללבם של עורכי העיתון "ניוזוויק". יתרה מזאת, הרופא המושיע בעצמו נכה צה”ל. ד”ר גור, קצין לשעבר ב”שלדג”, איבד את רגלו בעקבות פציעה קשה במלחמת לבנון.
”אנחנו נותנים את הנשמה לכולם - לנפגעי תאונות דרכים ופיגועים, לחיילים, או לפלשתינים. עד לפציעה שלי לא הייתי מזוהה עם מחשבה פוליטית, אבל מאז שנפצעתי, תפיסת העולם שלי אומרת שלום, ולא משנה באיזה מחיר. במצבי, כשאני כה עסוק וכה מכור לעבודה, אני לא יכול להיות פעיל פוליטית, אבל אם בפינה שלי אני יכול לעשות משהו שיקרב בין הצדדים, אז מבחינתי, זו התרומה שלי לשלום”.
מריח את הסרטן
ד”ר חוסאם חאיק פיתח אף אלקטרוני שמאבחן מחלות סרטן
גיל ומצב משפחתי: 31, נשוי.
מגורים: חיפה.
קריירה: סיים תואר ראשון בהנדסה כימית באוניברסיטת בן גוריון, ולאחר מכן דוקטורט במסלול ישיר בטכניון. את הפוסט דוקטורט הוא עשה במכון וייצמן באלקטרוניקה מולקולרית ובהמשך במכון הטכנולוגי של קליפורניה (Caltech), שם חקר את התחומים של התקנים חשמליים מבוססי ננו־חומרים ואפים אלקטרוניים. כיום משמש כחוקר ומרצה בפקולטה להנדסה כימית ומכון ראסל ברי למחקר בננו־טכנולוגיה בטכניון ועומד בראש המחקר על האף האלקטרוני.
הזכייה: מענק מטעם האיחוד האירופי על סך 1.73 מיליון יורו.
מאחורי המיקרוסקופ: ”במהלך לימודי הדוקטורט שלי חלה אחד מחבריי לעבודה בסרטן. מחלתו גרמה לי לחשוב על הנושא ועל פיתוח כלים שיעזרו לאבחן את המחלה ולטפל בה. הנושא של אפים אלקטרוניים קיים מאז שנות ה־80, אבל מכיוון שהחיישנים באפים הקיימים כיום גדולים יחסית, דרגת הרגישות שלהם נמוכה ולכן היישומים שלהם מוגבלים מאוד. נוסף על כך, ההתקנים האלה הם בגודל של מקרר קטן, ועלותם מאות אלפי דולרים. רציתי לפתח התקן הרבה יותר קטן, ושהעלות שלו תעמוד על 500־1,000 דולר, כך שהוא יהיה זמין לכל רופא משפחה, ולא יהיה צורך להמתין בתור לבדיקה. התחלתי לחקור את הנושא, אך על המענק שמעתי שבועיים לפני המועד האחרון להגשת המועמדות. זה היה טירוף לכתוב הצעת מחקר בתוך שבועיים ובכל זאת החלטתי לנסות. לקחתי חופשה מהעבודה, ובמשך שבועיים עבדתי 22 שעות ביממה.

”מדובר במערכת שמדמה את האף האנושי ונועדה לאבחן באמצעות בדיקת נשימה אם האדם חולה בסרטן או לא, לזהות באיזה סוג סרטן מדובר ואף לקבוע באיזה שלב נמצאת המחלה. ה’אף’ הוא למעשה התקן דמוי טלפון סלולרי, הכולל חיישנים זעירים בגודל ננו־מטרי ומוח אלקטרוני. בקצה ההתקן יש צינורית דקה, שלתוכה ינשוף הנבדק, כשהתוצאה תופיע באופן מיידי על צג המכשיר. בדומה לאף האנושי אפשר ללמד את החיישנים באף האלקטרוני ’להריח’ כל ריח נתון בעולם. בזכות גודלם הזעיר - פי 100 אלף פחות מקוטר שערה - החיישנים רגישים ביותר, ומסוגלים להריח את השינויים בהרכב החומרים הנפלטים עם הנשימה שמאפיינים מחלות סרטן, ואפילו את השינויים בהרכב החומרים בשלבים השונים של הסרטן.
"היתרון החשוב ביותר של השיטה הוא בכך שהיא תאפשר את אבחון המחלה בשלב מוקדם מאוד, עוד לפני שהגידול מתחיל להתפשט, כך שיהיה אפשר לטפל בה מיד ולחסל אותה בעודה באיבה.
”כיום, על אף כל השיטות המשוכללות הקיימות, גילוי הסרטן אפשרי רק כשהמחלה נמצאת בשלב השלישי מתוך חמישה שלבים, שבו כבר קיים גידול שאפשר לזהותו בבדיקות דימות כמו CT או בממוגרפיה. למרבה הצער, הסטטיסטיקות מראות שכשהמחלה מאובחנת בשלב זה, שיעור ההחלמה ממנה בתוך חמש שנים מיום הגילוי עומד על 15% בלבד. באמצעות האף האלקטרוני יהיה אפשר לזהות את הסרטן בשלבים הראשוניים ביותר, כשהוא מתבטא בשינויים ברמת תאים ספורים, עוד בטרם נוצר גידול, ולהגדיל את אחוז ההישרדות ל־80%, ובחלק מסוגי הסרטן אפילו ל־90%. היום הפיתוח נמצא בשלב שבו אנו מסוגלים לאבחן אם האדם חולה בסרטן או לא, ובקרוב נתחיל מחקר בשיתוף עם בית החולים רמב”ם, שבו ננסה בשלב ראשון לאבחן סרטן ריאות וסרטן השד - שניים מסוגי הסרטן השכיחים ביותר. אבל עדיין לפנינו עבודה של כמה שנים עד לסיום הפיתוח”.
לתפארת מדינת ישראל: ד"ר חאיק זכה במענק מצוינות על שם מארי קירי. המענק ניתן על־ידי האיחוד האירופי במסגרת מאמציו לחזק ולעודד מדענים צעירים ומבטיחים. הסכום, 1.73 מיליון יורו, הוא הראשון מסוגו בארץ והגדול ביותר שקיבל מדען ישראלי אי פעם. ד"ר חאיק: ”כשהודיעו לי על הזכייה שמחתי, אבל אז הבנתי את כובד האחריות המוטל עלי כלפי החברה והחולים שתולים תקוות בפיתוח. לכן אני עובד מסביב לשעון. בכסף שקיבלתי קניתי ציוד והתחלתי בגיוס חוקרים מהארץ ומחו”ל”.
מהנדסת הרקמות
ד"ר שולמית לבנברג פיתחה שיטה ליצירת רקמות שהגוף אינו דוחה
גיל ומצב משפחתי: 37, נשואה+ 5.
מגורים: מצפה מורשת, יישוב בגוש משגב שבגליל התחתון.
קריירה: סיימה תואר ראשון בביולוגיה באוניברסיטה העברית בירושלים, ולאחריו התקבלה למסלול ישיר לדוקטורט במכון וייצמן, בתחום הביולוגיה המולקולרית. את מחקר הפוסט־דוקטורט עשתה במכון הטכנולוגי של מסצ’וסטס (MIT), שם שהתה חמש שנים כעמיתת מחקר. כיום היא חוקרת ומרצה בכירה, העומדת בראש מעבדה בפקולטה להנדסה ביו־רפואית בטכניון, וממשיכה במחקרים בנושא הנדסת רקמות.
הזכייה: נבחרה על־ידי כתב העת המדעי Scientific American כ”מנהיגת מדע עולמית” ונכללה ברשימת 50 המדענים המובילים בעולם.
מאחורי המיקרוסקופ: ”עבודת הדוקטורט שלי, שאותה עשיתי במעבדה של פרופ’ בני גייגר במכון וייצמן, התמקדה בנושא של תקשורת ומגעים בין תאים - איך תאים ’משוחחים’ זה עם זה וכיצד עוברים אותות לתוך התא פנימה. במהלך העבודה קראתי חומר על הנדסת רקמות שריתק אותי מאוד, ובעיקר נמשכתי לעובדה שהנושא הזה מאפשר ללמוד לא רק כיצד מתרחשים המגעים בין התאים בצלחות פטרי במעבדה, אלא איך מתארגנים התאים וכיצד הם מתקשרים בפועל בגוף, בתלת ממד. כשסיימתי את עבודת הדוקטורט הצטרפתי כחוקרת פוסט־דוקטוריאלית למעבדה של פרופ’ רוברט לנגר, שהוא מחלוצי הנדסת הרקמות במכון הטכנולוגי של מסצ’וסטס (MIT). במהלך העבודה התפתח המחקר ליישומים קליניים - מלימוד על רקמות, לייצור רקמות לשימושים רפואיים.

”אחת המגבלות בפיתוח רקמות מהונדסות העומדות כיום בפני החוקרים היא יכולתן של הרקמות האלה להיקלט בגוף. מאחר שתהליך החדירה של כלי הדם לתוך הרקמה המושתלת אינו מהיר מספיק, הרקמה עלולה למות בגלל חוסר אספקת דם. הרעיון שעליו אני עובדת בשנים האחרונות הוא ליצור רקמה מהונדסת שבתוכה יש מערך של כלי דם, כדי לעודד את היקלטות השתל. יצירת כלי דם בתוך הרקמה מסייעת לשמור על חיי הרקמה בעת צמיחתה, להביא להתפתחותה המסודרת ולאפשר משיכה מהירה של כלי דם נוספים אליה לאחר השתלתה.
”ביחד עם קבוצת חוקרים מאוניברסיטת MIT עבדתי בשלב ראשון על רקמת שריר. הצלחנו ליצור במעבדה רקמת שריר מתאי גזע עובריים, ולהחדיר לתוכה רשתות כלי דם. לשם כך פיתחנו שיטה המבוססת על שימוש ב’פיגום’ תלת ממדי מתכלה העשוי מפולימרים סינתטיים. על ה’פיגום’, שהוא דמוי ספוג בעל נקבוביות, ’זורעים’ את תאי הגזע, כשהמטרה היא שהם יתמקמו בתוך הנקבוביות ויתחילו להתרבות, להתמיין וליצור רקמה חיה בעלת תכונות רצויות. עם הזמן מתכלה הפיגום הסינתטי מעצמו, והרקמה משתלבת לחלוטין בתוך האיבר החי שבו הושתלה. ואכן, כשהשתלנו את השריר המהונדס בגוף בעלי חיים, הצלחנו להוכיח שהשיטה משפרת את היקלטות השתל”.
לתפארת מדינת ישראל: Scientific American נחשב לאחד ממגזיני המדע היוקרתיים ביותר, ומאז היווסדו בשנת 1845 פרסמו בו את מאמריהם יותר ממאה חתני פרס נובל. ב”רשימת ה־50” היוקרתית של המגזין מופיע השנה גם סגן נשיא ארצות הברית לשעבר ואיש איכות הסביבה אל גור, ובעבר הופיעו בה מייסדי”גוגל” לארי פייג’ וסרגי ברין, חוקר תאי הגזע העובריים דגלאס מלטון, חתן פרס נובל רודריק מקינון ומדענים חשובים נוספים. ”עיתוננו בחר את הארגונים או היחידים שמקדמים את המדע והטכנולוגיה ומניחים את היסודות לעתיד טוב יותר”, כתב עורך כתב העת, ג’ון רני. ”בחירתם לרשימת ה־50 לא רק מעניקה להם את הכבוד הראוי, אלא גם מאירה את התחומים החשובים הנהנים מהישגיהם”.
ד"ר לבנברג: ”ההכרה של Scientific American בהחלט נותנת לנו מוטיבציה להמשיך ולחקור את התחום ולקדם את היכולת לייצר במעבדה רקמות ואיברים המיועדים להשתלה ולריפוי של מחלות ניווניות, כך שיהיה אפשר ליישם את השיטה בבני אדם”.
מתקן הלבבות
פרופ’ ליאור גפשטיין פיתח תאי לב וקוצבי לב מתאי גזע עובריים
גיל ומצב משפחתי: 37, נשוי ואב לתאומים בני שלושה חודשים.
מגורים: חיפה.
קריירה: לאחר סיום לימודי הדוקטורט בטכניון עסק במחקר בטכניון, שבמהלכו היה שותף בפיתוח מערכת תלת־ממדית שממפה את הפעילות החשמלית של הלב. בו זמנית התמחה ברפואה פנימית ובקרדיולוגיה בבית החולים רמב”ם, ונוסף על כך משמש גם כמומחה לאלקטרופיזיקה, הקים את המעבדה לחקר הלב בפקולטה לרפואה בטכניון שבראשה הוא עומד ומרצה במחלקה לפיזיולוגיה בטכניון.
הזכייה: פרס על שם זייפס שמעניק האיגוד האמריקאי לקרדיולוגיה לחוקר מצטיין בתחום.
מאחורי המיקרוסקופ: ”אי ספיקת לב היא מחלה האחראית כיום ליותר אשפוזים מכל מקרי הסרטן גם יחד, ו־50% מהחולים בה מתים בתוך חמש שנים. במצב של אי ספיקת לב קשה הפתרון היחיד הוא השתלת לב, אבל בשנים האחרונות מתפתח קונספט מחקרי חדש שלפיו יוחלף האזור הפגוע ברקמת לב חדשה שתיווצר מתאי גזע עובריים. על הקונספט הזה אני עובד.
"לפני כשבע שנים הצלחנו ליצור תאי גזע אנושיים מתאי גזע עובריים. היינו הראשונים בעולם שעשו זאת. בחנו את התאים במיקרוסקופ אלקטרוני וראינו שיש להם מבנה של תאי לב צעירים. בדקנו את הפעילות החשמלית שלהם, ולשמחתנו היא הייתה דומה מאוד לזו שרושמים בלב של אדם. בהמשך, כשנתנו לתאים אדרנלין, ראינו שהם פועמים מהר יותר בדיוק כמו שמתנהג לב אנושי לאחר מתן אדרנלין. היינו מרוצים מאוד, כי אם התאים האלה נראים ונשמעים כמו תאי לב, כנראה הם תאי לב.

”בהמשך הצלחנו להוכיח שתאי הלב עובדים כיחידה אחת, ולמעשה, כמעין לב שלם בזעיר אנפין, כולל אזור שמתפקד כקוצב לב. כשהוספנו במעבדה את תאי הלב לתרבית תאי לב של חולדה, בתוך כמה שעות החלו שתי הרקמות לפעול בצורה סינכרונית. הפעילות החשמלית עברה מהרקמה של החולדה לרקמה האנושית. בשלב הבא של המחקר, שעדיין לא פורסם, השתלנו את תאי הלב האנושיים שיצרנו לתוך לב של חולדה שסבלה מאי ספיקת לב, וראינו שהתאים האנושיים השתלבו בתוך פעילות תאי הלב ושיפרו את פעילות הלב.
”הנושא השני שעליו אני עובד הוא פיתוח קוצב לב שיחליף את הקוצב המלאכותי המושתל כיום בחולים הסובלים מהפרעות קצב לב איטיות. הקוצבים הקיימים כיום משוכללים מאוד ועובדים בצורה מצוינת, אבל בכל זאת הם לא יכולים להשתוות
לקוצב הטבעי. נוסף על כך, השתלתם כרוכה בניתוח ומדי כמה שנים יש צורך להחליף את הסוללה. כשגילינו שלתאי הלב שנוצרים מתאי הגזע יש אזור שפועל כקוצב, החלטנו לנסות ליצור קוצב לב ביולוגי במקום הקוצב המלאכותי, כשההשתלה תיעשה באמצעות צנתור, שבמהלכו נזריק את תאי הגזע לאזור הפגוע בלב. ואכן, כשהשתלנו את התאים שתפקדו כקוצב בלב של חזירים שסבלו מקצב לב איטי, ראינו שהתאים החלו לקצב את הלב, ולמעשה עבדו כקוצב ביולוגי. על אף ההצלחות המרשימות, המרחק מכאן ועד לטיפול בחולים עדיין גדול, משום שיש בעיות רבות שצריך לפתור. עם זאת, אני מאמין שבתוך כעשר שנים נתחיל כבר לראות ניסיונות בטיפול בחולים”.
לתפארת מדינת ישראל: הפרס על שם זייפס שמעניק האיגוד האמריקאי לקרדיולוגיה, נחשב לפרס יוקרתי ביותר בתחומו, והוא מחולק מדי שנה במסגרת הכינוס השנתי של האגודה שנערך באטלנטה, בהשתתפות 35 אלף קרדיולוגים. בנימוקיה להענקת הפרס אמרה ועדת הפרס: ”פרופ' גפשטיין מהווה דוגמה לרופא־חוקר מעולה. הישגיו המדעיים בתחומים של המיפוי החשמלי והמכני של הלב ובתחומי המחקר המתפתחים של תאי גזע, הנדסת רקמות, ורפואה רגנרטיבית עומדים בסטנדרטים הגבוהים של הפרס”.
”אני חושב שפשוט היה לי מזל לעסוק בכמה תחומים שהם פורצי דרך בקרדיולוגיה ושזוכים כיום לתשומת לב רבה”, הוא מצטנע. ”יש המון אנשים שעושים מחקרים טובים וחשובים מאוד, אבל אנחנו עשינו מדע טוב בתחומים שזוכים כיום לפרסום”.








