בשנת 2001 הכתה "פצצת אטום" בקהילייה המדעית, ובעולם הרפואה בפרט: מדענים פרסמו כי הם מצאו את הוראות ההפעלה העתיקות ביותר של המין האנושי – הגנום האנושי. בשנה זו אותו גנום, שמורכב מלא פחות מ־3 מיליארד בסיסים החוזרים ברצפים שונים, פוצח ב־92% ונמצאו כ־25 אלף גנים שאחראים למכונה המשוכללת והמרתקת שאנו מכירים בשם "גוף האדם". מאותו הרגע החל עולם מדע הרפואה בניסיונות לרתום את הפיצוח הזה לטובת אבחון וטיפול במחלות גנטיות.
מקור המילה "גנטיקה" הוא ביוונית עתיקה ומשמעותה היא "מקור", ואכן המקור של כולנו הוא ב־DNA שלנו. אבל לעתים משהו משתבש במקור. ״מחלה גנטית היא מחלה שנובעת מטעות בגן מסוים”, מסביר פרופ׳ שי בן שחר, מנהל המחלקה לרפואה גנומית ומותאמת אישית בשירותי בריאות כללית, ״וחשוב להבחין כאן בין שני הסוגים העיקריים: מחלה גנטית שמקורה בהורשה ומחלה גנטית שמקורה בפגם ב־DNA של החולה. מחלה גנטית תורשתית היא מחלה שמקורה בהורשה של גן פגום על ידי שני ההורים (כשמדובר במחלה רצסיבית) או על ידי הורה אחד (כשמדובר במחלה דומיננטית). אז למעשה מדובר במחלה שמקורה בשינוי בגן והיא משפיעה על כל תאי הגוף. דוגמה למחלה כזאת היא ציסטיק פיברוזיס. אם אקבל עותק אחד לא תקין של הגן, אז כנראה אהיה נשא של המחלה אבל לא חולה. לעומת זאת, אם שני הוריי היו נשאים והורישו לי את הגן הלא תקין, יש סבירות גבוהה מאוד שאהיה חולה בציסטיק פיברוזיס. אך כאמור, מחלה גנטית יכולה להיות גם מחלה שבה חל שינוי בגן שמקורו לא בהורים אלא בתקלה של הגוף - וגם פה יש מנעד של מחלות. דוגמה לכך היא תסמונת דאון. מדובר במחלה גנטית, אבל מקורה לא בהורים אלא בחלוקה לא טובה של כרומוזומים והשלשה של כרומוזום 21״.
התפנית: מאבחון לטיפול
כאמור, הגנום האנושי כבר פוצח לפני 23 שנה, אבל לדברי פרופ' בן שחר, התפנית הגדולה ביותר התרחשה רק בשנים האחרונות. "עד לפני כמה שנים לא ידענו לטפל בכלל במחלות גנטיות", הוא מסביר. "האבחון עזר לנו להיות בעיקר במעקב ונתן לנו כלים לאתר למשל אישה שהיא נשאית לגן BRCA1 שגורם לסרטן השד. לאחר האיתור קל לעשות צעדי מניעה ולמנוע תמותה. זווית נוספת לעניין היא להבין את הסיפור המשפחתי: אם נולד ילד עם מחלה, אנו יכולים לזהות את הרצף הגנטי שלו ושל ההורים שלו ולהבין אם המחלה הורשה לו על ידי ההורים ויש סבירות שהיא תופיע גם בהיריון הבא, או שמא מדובר באירוע נקודתי שלא אמור להשפיע על הילדים הבאים״.
את התפנית שחלה במעבר בין האבחון לטיפול גנטי אפשר להמשיל לשפה. כשאנחנו לומדים שפה, אנחנו לומדים לדבר, לכתוב ולקרוא אותה. אבל רק מהרגע שאנחנו שולטים בה טוב מספיק, אנחנו יכולים להתחיל לתקן שגיאות כתיב ולהתנסח טוב יותר. כך גם במקרה של הגנום האנושי – מרגע שלמדנו איך לקרוא אותו ולדבר את השפה של הגוף, אנחנו יכולים להתחיל לתקן את שגיאות הכתיב שלו. אז מה למדנו עד כה על ריפוי גנטי, ואילו פריצות דרך נעשו בתחום בשנים האחרונות?
ניוון שרירים שדרתי: רצף RNA שמשנה את יעד התרגום
מחלת ניוון שרירים שדרתי (SMA) היא מחלה גנטית תורשתית שמופיעה ב־1 ל־11,000 לידות. באדם בריא הגן SMN אחראי על ההיווצרות התקינה של עצבים מוטוריים שדרתיים שבתורם אחראיים לכל תנועת השלד. בחקר המחלה התגלה כי הגן SMN1 (מתוך ארבעה הקיימים) הוא הגן העיקרי לייצור נוירונים אלה. כשאדם נושא שני עותקים פגומים (בעלי מוטציה) של SMN1 (שהורשו לו גם על ידי אביו וגם על ידי אמו) ייצור הנוירונים נפגע ומוביל לניוון שרירים ולמרבה הצער למוות עד גיל שנתיים ברוב המקרים.
עד 2016 מחלה זו נחשבה לחשוכת מרפא, אך בשנה זו חברת Biogen השיקה תרופה פורצת דרך בשם ספינרזה. עוד לפני פיתוח התרופה הראו מחקרים כי ייצור החלבון SMN נעשה בעיקר על ידי SMN1 וכי SMN2 זהה לו כמעט לחלוטין, למעט בכמה חומצות אמיניות. הבעיה? במצבו הבריא תרומתו של SMN2 לייצור חלבון מזערית ביותר מכיוון שחסר בו מקטע שקיים ב־SMN1. החוסר במקטע נובע במעבר מ־DNA לחלבון. ואם להיות מדויקים, ממש לאחר היווצרות מולקולת ה־RNA שליח (mRNA).
הפיצוח: החוקרים פיתחו שיטה בשם ASO (Antisense Oligonucleotide). בשיטה זו מקטע של רצף מהונדס נצמד למולקולת ה־mRNA של SMN2 ומונע ממנה לעבור עריכה באזור מסוים. במילים פשוטות: ה־ASO מונעת את הסרת המקטע החסר ב־SMN2 והופכת אותו ל־SMN1 בריא ותקין. מדובר בפריצת דרך של ממש, שכן הנדסה ביולוגית פשוטה יחסית הצליחה לגרום באופן כמעט טבעי לעקיפת הפגם המולד על ידי עריכה גנטית ולייצור החלבון התקין באמצעות מערכות התא.
3 צפייה בגלריה
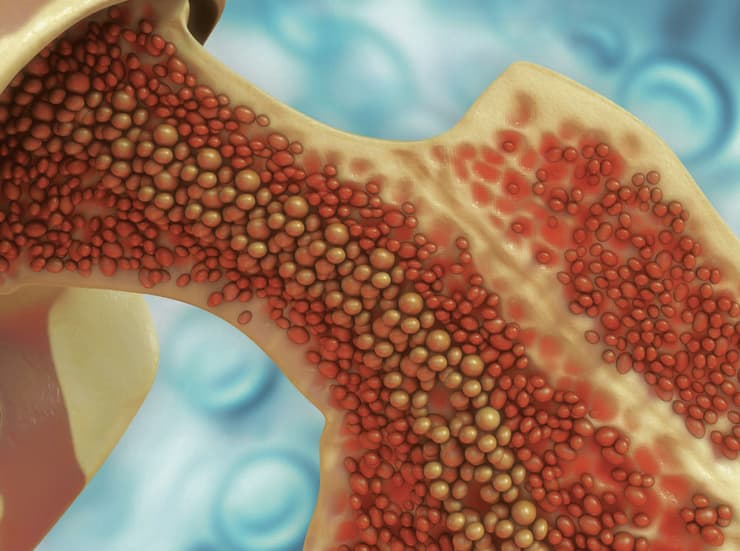

הקריספר מסירה את הגן הפגום ומחדירה במקומו גן תקין. תאי מוח עצם
(צילום: שאטרסטוק / א.ס.א.פ קריאייטיב )
אנמיה חרמשית: הסרת הגן הפגום והחדרת גן תקין
המוגלובין הוא חלבון המצוי בדם שלנו ותפקידו לשאת חמצן מהריאות אל תאי הגוף. לחלבון מקודד הגן HBB. אחת המחלות הגנטיות המפורסמות ביותר בעולם היא אנמיה חרמשית. זו מחלה גנטית תורשתית וככזו דורשת שני עותקים פגומים של הגן HBB. בשל המחלה מולקולת ההמוגלובין פגומה וכדורית הדם האדומה נראית כמו חרמש. הצורה הזאת לא מאפשרת העברת חמצן יעילה, ולחולים בה יש סבירות גבוהה בהרבה להתייבשות, לכאבים עזים בכלל הרקמות ובמקרים חריגים אפילו למוות של רקמה. מחקרים הראו כי בחלק מהמקרים מספיק להיות אפילו נשא, כלומר בעל עותק אחד פגום של HBB, כדי להראות תסמינים קלים. בארצות הברית עצמה יש יותר מ־100,000 חולים באנמיה חרמשית, ובישראל ההערכה היא כי יש כמה מאות עד אלפים.
ולמה אנחנו מספרים לכם את זה? כי בדצמבר האחרון ה־FDA (מינהל המזון והתרופות האמריקאי) אישר בצעד יוצא דופן את הטיפול הראשון במחלה גנטית באמצעות קריספר – מערכת לעריכה גנטית.
הפיצוח: עד כה במקרים חמורים של המחלה נדרשו המטופלים לעבור השתלת תאי מוח עצם מתורם. כעת תרופה בשם Casgevy הופכת אותם לתורמי מוח העצם של עצמם. בתהליך, שנמשך כמה חודשים, נשאבים תאי מוח עצם מדמו של המטופל. התאים האלה עוברים למעבדה שבה Casgevy מסירה באמצעות הקריספר את גן ה־HBB הפגום ומחדירה במקומו את הגן התקין. לאחר מכן תאי מוח העצם עוברים סריקה ובסופו של דבר חוזרים לגופו של המטופל.
היתרון? אין כמעט סכנה של דחיית התרומה מכיוון שהמטופל עצמו הוא התורם. הקאץ'? אף על פי שהטיפול מאושר על ידי ה־FDA, מחירו עומד כיום על 2.2 מיליון דולר!
אפידרמוליזיס בולוזה: החדרת גן תקין באמצעות נגיף מהונדס
אפידרמוליזיס בולוזה (DEB) היא מחלה גנטית תורשתית רצסיבית המהווה את נחלתם של כ־500 אלף חולים ברחבי העולם. במחלה זו שתי שכבות העור החיצוניות - האפידרמיס והדרמיס - מתנתקות זו מזו ויוצרות מבנים של שלפוחיות המזכירות כוויות. העור הוא אחד האיברים החשובים ביותר ומהווה את ההגנה על הגוף מפני התייבשות וחדירת מחוללי מחלה, ולכן מחלה זו גורמת לסבל רב ואף מוות ללוקים בה. הגורם למחלה הוא מוטציה יחידה בגן COL7A1 שאחראי לייצור סיבי קולגן. סיבים אלה מחברים בין הדרמיס לאפידרמיס, וכשיש מוטציה, החיבור הזה נהרס והשכבות נפרדות. עם זאת, טיפול גנטי בעור, האיבר הגדול ביותר בגוף, מורכב ביותר שכן נדרש טיפול רחב מאוד בעל יכולת לחדור את האפידרמיס ולהגיע לדרמיס עצמו.
הפיצוח: Vyjuvek – ג'ל המכיל נגיף הרפס מהונדס גנטית. נגיפי ההרפס יודעים לחדור את העור היטב ולהתחמק ממערכת החיסון, מה שהופך אותם למעין שליח דואר שאפילו הכלב בחצר אוהב.
איך זה עובד? מרוקנים את נגיף ההרפס מתוכנו ומכניסים את הגן התקין של COL7. את הג'ל המכיל את הנגיף מורחים על "הכוויות" וכך הנגיף מדביק את התאים החולים וגורם להם לבטא את החלבון התקין. בתוצאות מחקר קליני שפורסם בדצמבר אשתקד ובו השתתפו 31 איש, נמצא כי בקבוצת הטיפול הייתה החלמה של כ־70% לאחר מריחת הג'ל, לעומת 20% בלבד בקבוצת הפלצבו. ממצאים אלה הביאו את ה־FDA לאישור Vyjuvek במאי האחרון, ומדובר בטיפול הפלסטי־גנטי טופיקלי הראשון שמאושר.
הסיפור הזה לא נגמר כאן. בחלק מהחולים המחלה פוגעת גם בעין ועלולה לגרום לעיוורון. לאחר שאחד המשתתפים במחקר, שהמחלה פגעה גם בעיניים שלו, הגיב מצוין לטיפול בעור, הרופא המטפל בו החליט לייצר עבורו טיפות עיניים על בסיס הג'ל והצליח להחזיר לו את הראייה במידה בלתי מבוטלת.
אמנם הטיפול אינו מהווה מרפא לחולי DEB, אך הוא פתח שדה חדש לגמרי של טיפולים גנטיים. האם בעתיד הקרוב נוכל לראות משחות, ג'לים וטיפות שיוכלו לבצע שינויים גנטיים בעור שלנו גם למטרות אחרות? ככל הנראה כן. סיבי הקולגן חשובים ביותר גם בנושא הזדקנות העור, ולכן מרגע ששמנו ידינו על היכולת הזאת, אין לה ברירה אלא להמריא.
3 צפייה בגלריה
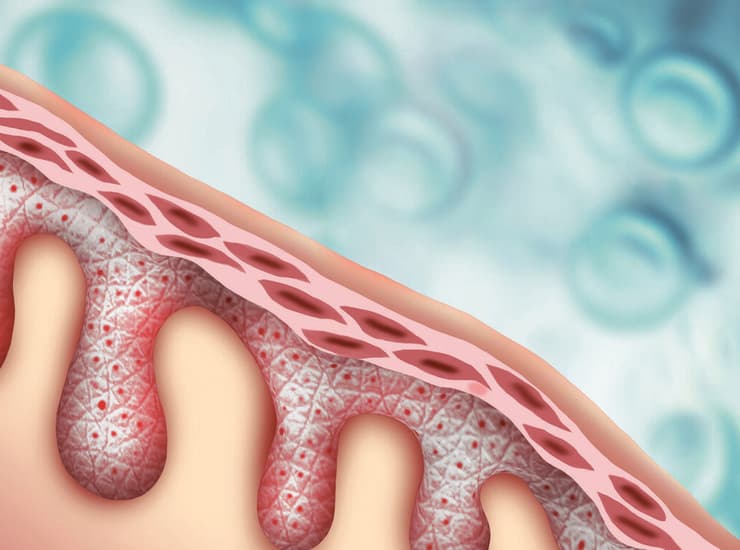

גן תקין מוחדר באמצעות נגיף הרפס מהונדס. שכבות העור החיצוניות
(צילום: שאטרסטוק / א.ס.א.פ קריאייטיב )
עמילואידוזיס: השתקה של ביטוי גן באמצעות הפרעת RNA
עמילואידוזיס היא מחלה גנטית תורשתית ודומיננטית. הלוקים בה חווים הפרעות במערכת העצבים ולרוב סובלים מקושי בתנועה, מבעיות חריפות במערכת העיכול, מהפרעות לבביות וסחרחורות חוזרות ונשנות. מחלה זו נחשבת למחלה תורשתית קשה שמפריעה לאורח החיים באופן מובהק. הגורם למחלה הוא פגם בעותק אחד בלבד של הגן TTR שמקודד לחלבון טרנסטירטין, שאחראי בעיקר להעברת הורמונים בגוף. המוטציה בגן גורמת לחלבון להתקפל בצורה לא נכונה, להתפרק - ובעקבות זאת לשקוע באיברים וברקמות הגוף השונים ולחולל נזק.
הפיצוח: תרופה בשם Onpattro המבוססת על שיטה בשם RNA interference) RNAi), או בעברית – הפרעת RNA, של חברת Anylam. במעבר בין DNA לחלבון יש מולקולת ה־RNA שליח (mRNA). באמצעות השיטה דו־גדיל של RNA נקשר ל־mRNA של גן ה־TTR. התא שלנו לא יודע להכיל דו־גדילים של RNA אלא רק של DNA ולכן שולח מיד אנזימים לחסל אותם. בעקבות זאת החלבון לא נוצר וכך הוא אינו שוקע.
בניגוד לתרופות הקודמות לא מדובר כאן בהתערבות ברמת ה־DNA, אלא בהתערבות לפני המעבר לחלבון. כיום Onpattro היא תרופת ה־RNAi הראשונה שמאושרת לשימוש על ידי ה־FDA ובמחקרים קליניים הראתה שיפור בקבוצת הטיפול לעומת קבוצת הביקורת. עם זאת, ה־FDA דחה את בקשת החברה להרחבת השימוש בתרופה למצבים נוספים בטענה כי היעילות שהציגה החברה נמוכה ביחס לתופעות הלוואי האפשריות.
אלצהיימר: "השתלת" מוטציה עמידה למחלה
מחלת האלצהיימר היא נחלתם של 55 מיליון בני אדם ברחבי העולם כיום, ולפי מומחים, בשנת 2050 מספר החולים בה יעמוד על כ־150 מיליון איש. זה נתון מטריד שמדיר שינה מעיניהם של רבים בקהילייה הרפואית, וכיום האלצהיימר היא בחוד החנית של מחקר מחלות המוח. המחלה נגרמת עקב שקיעה של חלבונים בשם בטא־עמילואידים. ככל שהמוח מתבגר, הוא יודע לפרק אותם פחות טוב וזה מה שמביא לשקיעתם ובעקבות זאת למחלה. התרופות הקיימות כיום יודעות לעכב את המחלה אך לא במידה מספקת.
אמנם האלצהיימר אינה בהכרח תורשתית, אך יש לה רכיב גנטי. באדם קיים גן בשם APOE שלו שלושה עותקים: APOE3, APOE2 ו־APOE4. בעוד APOE2 ו־3 ידועים כגורמי סיכון נמוכים למחלה, הרי ש־APOE4 מעלה את הסבירות לחלות באלצהיימר בעשרות אחוזים.
רוב התרופות שנמצאות כיום בפיתוח מכוונות דווקא למסלולים ששמים לעצמם למטרה את הבטא־עמילואידים, אך חוקרים מאוניברסיטת סן פרנסיסקו פרסמו בנובמבר האחרון מחקר שמראה כי ייתכן שההסתכלות כולה צריכה להשתנות. במחקר, שפורסם בכתב העת היוקרתי Nature, הסבירו החוקרים כי בשנת 2019 נמצאה אישה שנושאת מוטציה ייחודית לגן APOE שהפך אותה, בניגוד לכל הסיכויים הגנטיים והתורשתיים, לעמידה למחלת האלצהיימר. האישה, שלפי ההיסטוריה הרפואית הייתה אמורה לפתח אלצהיימר, הראתה סימנים של עמידות ארוכה.
הפיצוח: החוקרים יצרו באמצעות קריספר שלוש קבוצות של עכברים: עכברים הנושאים את הגן APOE4 (בעל הסיכון הגבוה לאלצהיימר) בלבד; עכברים הנושאים את APOE4 ואת הגן המוטנטי העמיד; ועכברים הנושאים את הגן העמיד בלבד.
נמצא כי העכברים שנשאו את הגן העמיד למחצה ובאופן מלא לא הראו תסמינים כלל או הראו תסמינים קלים בלבד לעומת קבוצת הביקורת. המרחק לטיפול במרפאה עומד כעת על כמה שנים, אך מרגע שהגן התגלה וטכנולוגיית הקריספר זמינה לטיפול בבני אדם, המרחק הולך ומתקצר.
הסכנה: החמצת המטרה
רוב השיטות שנמנות בכתבה פורצות דרך בתחום הריפוי הגנטי, אך לכולן יש גם תופעות לוואי וסכנות נלוות. המרכזית שבהן היא תופעת ה־Off Target (החמצת המטרה). ביולוגיה היא אינה מדע מדויק, ובניגוד לטיל בעל כוונון מדויק, את גדילי ה־DNA וה־RNA לפעמים קשה להכווין בדיוק לגן המטרה. זה עלול להוביל לכך שגנים אחרים ייפגעו ולייצר אפקט הפוך מזה שאליו התכוונו. לכן כל עוד הטכנולוגיות בפיתוח, הרשויות הרגולטוריות יהיו זהירות באישורן ויבקשו הוכחות מספקות ליעילות, ובעיקר לבטיחות, השימוש בהן.
הכותב הוא בוגר תואר שני מחקרי במדע הרפואה ועמית מחקרים קליניים





