חלבונים הם סוסי העבודה של התא אשר מוציאים לפועל את רובן המכריע של המשימות הנחוצות לשמור עלינו בריאים ושלמים. עם זאת, חלבונים פגומים עלולים ליצור במוח צברים מזיקים המעורבים באלצהיימר, בפרקינסון ובמחלות מוח ניווניות נוספות. עד לא מזמן הסברה הרווחת הייתה שברגע שנוצרים צברים אלה, המכונים משקעים עמילואידיים, אין דרך חזרה. אך מסתבר כי שיתוף פעולה בין שתי משפחות של חלבונים מלווים ("שפרונים") מאפשר לפרק את העמילואידים ולשמור על תאי גופנו במצב תקין.
בשני מאמרים שפורסמו באחרונה, חשפה מעבדתה של ד"ר רינה רוזנצויג מהמחלקה לביולוגיה מבנית, יחד עם חוקרים מאוניברסיטת היידלברג ומהמרכז הגרמני לחקר הסרטן (DKFZ), את המנגנון שבאמצעותו שתי משפחות החלבונים מפרקות את המשקעים העמילואידיים. פעולה זו משתלבת היטב במשימתם הכללית של השפרונים בתא: לשמור על תקינותם של חלבונים לכל אורך חייהם הפונקציונליים.
2 צפייה בגלריה
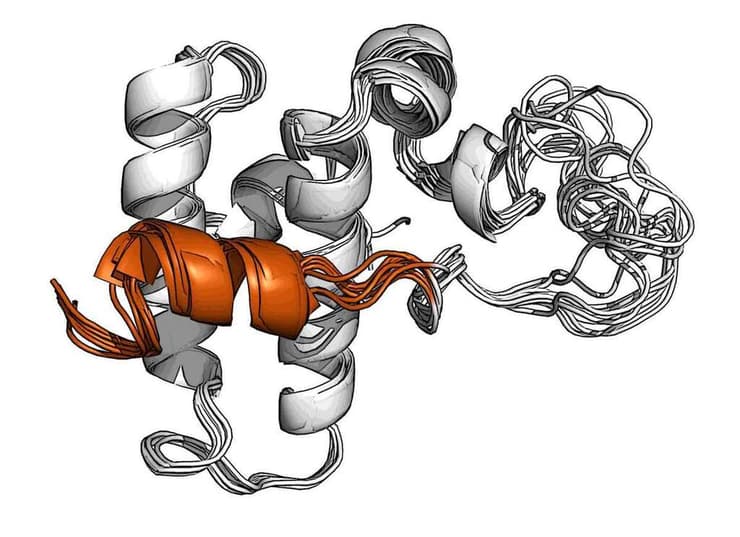

מנעול סלילי (כתום) על השפרון DnaJB1 חוסם את אתר הקישור לשפרונים ממשפחת Hsp70
(איור: מסע הקסם המדעי, מכון ויצמן)
במאמר הראשון, גילתה ד"ר אן וונטינק מקבוצתו של פרופ' ברנד בוקאו באוניברסיטת היידלברג, כי על מנת לפרק את משקעי העמילואיד, על שפרונים רבים מסוג Hsp70 להתאסף יחד באותה נקודה, להיצמד לחלבונים בודדים בתוך צבר העמילואיד ולמשוך אותם החוצה עד שהם משתחררים מהסבך. במאמר השני, גילו ד"ר עפרה פאוסט וד"ר מיטל אבייב-אברהם מקבוצתה של ד"ר רוזנצויג, מנגנון בקרה ייחודי המאפשר למשפחת השפרונים השנייה, Hsp40, לייצר מלכתחילה את אותו צבר Hsp70 הנחוץ לפירוק העמילואידים.
באמצעות ניסויים מתקדמים בתהודה מגנטית גרעינית במכון קלור לדימות וספקטרוסקופיה של תהודה מגנטית בעוצמות גבוהות, הצליחה קבוצתה של ד"ר רוזנצויג בשיתוף ד"ר ניר לונדון מהמחלקה לכימיה אורגנית, לפענח את המבנה של חלבון מסוים ממשפחת ה-Hsp40 המכונה DnaJB1. פענוח המבנה הראה כי DnaJB1 מכיל בתוכו סליל ייחודי החוסם באופן זמני את אתר הקישור למולקולת Hsp70. סליל זה הוא חלק ממנגנון בקרה דו-שלבי שלא היה מוכר עד כה, והוא זה המאפשר לשפרון זה, ולו בלבד, לגייס מולקולות ממשפחת Hsp70 באופן הנחוץ לפרק את העמילואידים.
2 צפייה בגלריה


מימין: ד"ר ניר לונדון, ד"ר רינה רוזנצויג, ד"ר מיטל אבייב-אברהם וד"ר עפרה פאוסט. מפצחים מנעולים
(איור: מסע הקסם המדעי, מכון ויצמן)
על מנת להתחיל במלאכת הפירוק, Hsp70 צריך קודם להיות מופעל על-ידי DnaJB1, שכבר קשור לעמילואיד, אך אתר הקישור חסום בידי המנעול הסלילי. לפיכך, Hsp70 נקשר תחילה לשפרון באתר אחר, באמצעות אזור בלתי מוסדר שלו, מעין "זנב" מולקולרי. פעולה זו משחררת את המנעול הסלילי ומאפשרת ל-Hsp70 להיקשר ל-DnaJB1 באתר הקישור הראשי, ובכך להפוך לפעיל ולהתחיל במלאכת פירוק העמילואידים. כעבור זמן מה המנעול הסלילי נסגר, Hsp70 משתחרר ו-DnaJB1, שעודנו מחובר לעמילואיד, מתפנה לתפוס חלבוני Hsp70 חדשים ולהפעילם באותו האזור. פעולה הולכת ונשנית זו מייצרת בסופו של דבר את המסה הקריטית של חלבוני Hsp70 הדרושים לפרק את המשקע העמילואידי.
הבנה חדשה זו של המנגנונים המולקולריים הפועלים לפירוק העמילואידים מעלה את השאלה אם התפתחות מחלות עצביות-ניווניות מלווה בהפרעה במנגנון זה – שאלה שהתשובה עליה יכולה לסלול דרך חדשה למאבק במחלות כגון אלצהיימר ופרקינסון. יתרה מכך, ממצאי המחקר עשויים לאפשר להבין תהליכים חיוניים נוספים בתא, שכן המדענים סבורים שמנעולים סליליים דומים מצויים בשימוש בשפרונים אחרים ממשפחת Hsp40.

