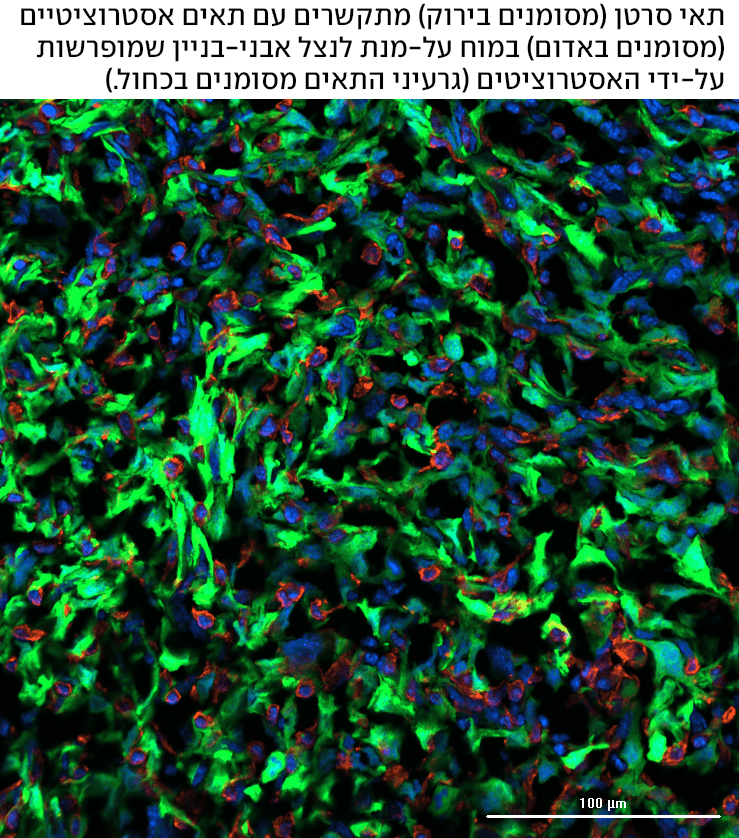
גרורות במוח הן אחד הסיבוכים הקטלניים והמתסכלים ביותר של סרטן השד. לרוב, לא הגידול הראשוני הוא שמכריע את גורל החולה, אלא היכולת של תאי הסרטן לחדור לאיברים חיוניים, להסתגל לסביבה זרה ולשגשג בה. למרות התקדמות דרמטית בטיפולים ביולוגיים ואימונותרפיים בשנים האחרונות, דווקא במוח האפשרויות הטיפוליות נותרו מוגבלות, והפרוגנוזה קשה. כעת, מחקר חדש בהובלת חוקרים מהפקולטה למדעי הרפואה והבריאות ע"ש גריי של אוניברסיטת תל אביב, מפצח את אחת התעלומות הקשות והקטלניות ביותר.
7 צפייה בגלריה


פריצת דרך כחול-לבן. פרופ' רונית סצ'י-פאינרו ופרופ' אורי בן-דוד מאוניברסיטת תל אביב
(צילום: דוברות אוניברסיטת תל-אביב)
המחקר החדש מציע לראשונה הסבר ביולוגי מגובש לשאלה שמעסיקה את עולם האונקולוגיה כבר שנים: איך סרטן השד מצליח "להתמקם" במוח - ולמה זה קורה רק אצל חלק מהחולות. הממצאים עשויים לא רק לסלול את הדרך לפיתוח תרופות חדשות, אלא גם לאפשר מעקב רפואי ממוקד-אישית: זיהוי מוקדם של חולות המצויות בסיכון מוגבר לגרורות מוחיות, והתאמת ניטור וטיפול כבר בשלבים הראשונים של המחלה.
7 צפייה בגלריה

החוקרים ביקשו לבדוק מדוע גידולים מסוימים שולחים גרורות דווקא למוח
(צילום: shutterstock)
המחקר, שפורסם היום (ב') בכתב העת Nature Genetics בוצע בהובלת פרופ' אורי בן-דוד ופרופ' רונית סצ'י-פאינרו, ובהשתתפות החוקרות ד"ר קתרין לאו וד"ר סבינה פוצי ממעבדותיהם באוניברסיטת תל אביב. במחקר שיתפו פעולה עשרות חוקרים מ-14 מעבדות בשש מדינות: ישראל, ארצות הברית, איטליה, גרמניה, פולין ואוסטרליה, והוא משלב ניתוח נתונים קליניים וגנומיים מחולות סרטן, ניסויי מעבדה מתקדמים ומודלים בעכברים, במטרה לפענח את אחד המנגנונים החמקמקים והקטלניים ביותר של המחלה.
סרטן השד הוא אחד מסוגי הסרטן שנוטים לשלוח גרורות למוח בשכיחות גבוהה יחסית. לצידו בולטים גם סרטן העור מסוג מלנומה וסרטן הריאות. למרות ההתקדמות בטיפולים בגידול הראשוני, הופעת גרורות מוחיות עדיין מהווה נקודת מפנה דרמטית במהלך המחלה, עם אפשרויות טיפול מוגבלות ופרוגנוזה קשה.
"מרבית מקרי המוות של חולי סרטן לא נגרמים על ידי הגידול הראשוני, אלא על ידי הגרורות שהוא שולח לאיברים חיוניים", מסבירה פרופ' סצ'י-פאינרו, ראש בית הספר למדעי הרפואה על שם גריי באוניברסיטת תל אביב וראש המרכז לחקר הסרטן באוניברסיטה. "בין אלה, גרורות במוח הן הקטלניות והקשות ביותר לטיפול. אחת השאלות החשובות והבלתי פתורות בחקר הסרטן היא מדוע גידולים מסוימים שולחים גרורות דווקא לאיברים ספציפיים ולא לאחרים. למרות חשיבות התופעה, מעט מאוד ידוע על הגורמים והמנגנונים שמאפשרים אותה".
פרופ' סצ'י-פאינרו: "כלי הדם במוח הם מאוד בררניים, ובכל זאת, תאי סרטן שעוזבים את הרקמה הראשונית, במקרה הזה את השד, מצליחים לחדור למוח ולשרוד בו. עולה השאלה - כיצד מצליחים תאי סרטן אלה לחדור את מחסום הדם-מוח?"
השאלה הזו מתחדדת במיוחד כשמדובר במוח - איבר המוגן על ידי מחסום הדם-מוח, שמונע חדירה של חומרים ותאים מהדם לרקמה המוחית. "כלי הדם במוח הם מאוד בררניים", אומרת פרופ' סצ'י-פאינרו, "ובכל זאת, תאי סרטן שעוזבים את הרקמה הראשונית, במקרה הזה את השד, מצליחים לחדור למוח ולשרוד בו. עולה השאלה - כיצד מצליחים תאי סרטן אלה לחדור את מחסום הדם-מוח?".
מעבר למחסום עצמו, כאשר מגיעים תאי הסרטן למוח, הם נתקלים בסביבה זרה לחלוטין. השד הוא איבר עשיר בתאי שומן, ואילו המוח מורכב מתאים אחרים לגמרי - נוירונים, תאי מערכת החיסון של המוח ואסטרוציטים, שתפקידם בין היתר לתמוך בנוירונים ולהזינם. "זו סביבה עוינת שתאי הסרטן האלה לא אמורים להכיר", מוסיפה סצ'י-פאינרו. "לכאורה, הם לא אמורים לשרוד שם, אך מסתבר שהאסטרוציטים, לא רק שאינם מפריעים, אלא הם אפילו עוזרים לתאי הסרטן להתמקם במוח. זו הסיבה שכל כך הסתקרנו לבדוק מה קורה שם - כיצד מצליחים תאי הסרטן להגיע למוח ולשרוד בו, וכיצד הם משתפים פעולה עם האסטרוציטים באופן שמאפשר להם לשגשג שם".

כש"שומר הגנום" מפסיק לשמור
המחקר הנוכחי שילב בין שתי גישות שונות לחקר הסרטן – המעבדה של פרופ' סצ'י-פאינרו, שחוקרת את הקשרים בין תאי סרטן לסביבתם בגוף (מיקרו-סביבה), והמעבדה של פרופ' אורי בן-דוד, פרופ' לגנטיקה של הסרטן, בבית הספר למדעי הרפואה על שם גריי, בפקולטה למדעי הבריאות והרפואה באוניברסיטת תל אביב, שחוקרת את הגנטיקה של תאי הסרטן עצמם, בדגש על שינויים כרומוזומליים אשר מאפיינים תאים סרטניים.
במסגרת המחקר המורכב, נעזרו החוקרים במספר רב של שיטות וטכנולוגיות מדעיות: ניתוח נתונים קליניים וגנומיים מחולות סרטן, ניסויים גנטיים, ביוכימיים, מטבוליים ופרמקולוגיים בתאי סרטן בתרבית, ניסויים פונקציונליים בעכברים וניסויים שבוצעו ישירות בדגימות מחולות שהגיעו היישר מחדר הניתוח.
כדי להבין מה מאפשר לתאי סרטן השד להתבסס דווקא במוח, בחרו החוקרים בגישה רחבה, שמשלבת בין נתונים קליניים, ניסויי מעבדה ומודלים בבעלי חיים. "ברמה הבסיסית ניסינו קודם כול למצוא, ברמה הגנטית, מה מבדיל בין גרורות במוח לגרורות באיברים אחרים, ומה מבדיל בין גידולים ראשוניים שיכולים לשלוח גרורות למוח לבין גידולים ראשוניים שאינם יכולים", מסביר פרופ' בן-דוד.
פרופ' סצ'י-פאינרו: "הגן שזיהינו, p53, נקרא 'שומר הגנום', כי כשהוא פעיל הוא הבקר שלנו. אם משהו לא בסדר בתא, הגן הזה דואג שהתא יתאבד. זו הדרך של הגוף למנוע התפתחות של סרטן - תהליך שנקרא אפופטוזיס. זה קצת כמו שעצים משירים עלים כדי להישאר בריאים"
בשלב הראשון ניתחו החוקרים נתונים מאלפי חולות סרטן שד. הם אספו מידע על המצב הגנטי של התאים, כולל מוטציות ושינויים כרומוזומליים, לצד דפוסי ביטוי גנים - הן מגידולים ראשוניים והן מגרורות. "השתמשנו במאגרי מידע גנומיים-קליניים מאוד גדולים, שנגישים לחוקרים", ממשיך פרופ' בן-דוד, "וזיהינו שמוטציה או שינוי כרומוזומלי שמערב גן מסוים מופיעים בשכיחות הרבה יותר גבוהה בגרורות במוח ובגידולים ראשוניים שיש להם נטייה להגיע למוח. זו הייתה התגלית הראשונה".
הגן שבלט במיוחד בניתוחים הללו הוא p53 - אחד הגנים הידועים והנחקרים ביותר בעולם הסרטן. "הגן הזה נקרא 'שומר הגנום', כי כשהוא פעיל הוא הבקר שלנו. אם משהו לא בסדר בתא, הגן הזה דואג שהתא יתאבד", מסבירה פרופ' סצ'י-פאינרו, "זו הדרך של הגוף למנוע התפתחות של סרטן - תהליך שנקרא אפופטוזיס. זה קצת כמו שעצים משירים עלים כדי להישאר בריאים".
אלא שכאשר הגן הזה נפגע, התמונה משתנה. "אחד הממצאים הראשונים שלנו היה שכבר בגידול הראשוני בשד ראינו אינאקטיבציה של p53 , כלומר פגיעה בפעילות שלו, בגידולים ראשוניים שיכולים לשלוח גרורות למוח", אומר פרופ' בן-דוד. "השאלה היא למה הגן הזה משמעותי במיוחד לשם שליחת גרורות למוח, להבדיל משליחת גרורות לאיברים אחרים בגוף, כמו כבד, ריאות ועצמות".
כדי לבדוק את המשמעות של הפגיעה הזו בצורה מבוקרת, יצרו החוקרים מערכת ניסויית שבה כל התנאים זהים פרט לפעילותו של p53. "לקחנו תאים שמקורם מחולות סרטן שד וגם תאי סרטן שד מעכברים. בנינו שתי שורות תאים עם אותו רקע גנטי, כאשר ההבדל היחיד הוא שבאחת p53 תקין ובשנייה הוא לא עובד", מתארת פרופ' סצ'י-פאינרו. "עשינו זאת באמצעות עריכה גנטית (קריספר)", מרחיב פרופ' בן-דוד. "וכך יכולנו לבחון בתרבית ובעכברים כיצד הפגיעה ב-p53 משפיעה על האופן שבו התאים גדלים, מתחלקים או נעים ממקום למקום" (קראו עוד על עריכה גנטית - בכתבה הבאה).
התוצאה הייתה חד-משמעית. "כאשר הזרקנו את התאים לעכברים, גילינו שהפגיעה ב-p53 העלתה דרמטית את היכולת של התאים האלו ליצור גרורות מוחיות", אומרת פרופ' סצ'י-פאינרו. בשלב זה ביקשו החוקרים להבין מדוע דווקא תאים חסרי p53 מצליחים להסתדר כל כך טוב במוח.
"כשהעמקנו ובדקנו מה מיוחד בהם", מסביר פרופ' בן-דוד, "גילינו ש-p53 מבקר ייצור של חומצות שומן - תהליך מטבולי אשר חיוני במיוחד בסביבה המוחית. במוח יש מחסור בשומנים זמינים לתאי הסרטן, ולכן הם נדרשים לייצר בעצמם את חומצות השומן. מנגנון הייצור הזה מבוקר על ידי p53, כך שפגיעה בגן מגבירה את יכולת ייצור השומנים של תאי הסרטן, וכך מאפשרת להם להתמודד עם המחסור בשומנים במוח".
החוקרים אף זיהו תקשורת מוגברת בין תאי סרטן עם p53 פגוע לבין אסטרוציטים. "האסטרוציטים מספקים לתאי הסרטן חומרים ואבני בניין שמאפשרים להם לא רק להגיע ולחנות שם, אלא ממש לגדול, לגייס את סביבת המוח ולהשתלט עליה", מסבירה פרופ' סצ'י-פאינרו, "הם משחיתים את הסביבה כדי שתעזור להם לגדול. אבני הבניין מהאסטרוציטים, לצד היכולת המוגברת של התאים להשתמש באבני הבניין האלה, מאפשרות לתאים בהם p53 חסר או פגוע לייצר יותר חומצות שומן בהשוואה לתאים תקינים, וכתוצאה מכך, הם מצליחים לגדול ולהתחלק מהר יותר במוח".
השלב השלישי כלל ניסויים פונקציונליים בעכברים. החוקרים עבדו עם שני סוגי מודלים: עכברים בעלי מערכת חיסון, שאליהם הוזרקו תאי סרטן שד של עכבר, ועכברים ללא מערכת חיסון, שאליהם הוזרקו תאי סרטן שד אנושיים. "ביצענו הזרקות ללב של העכבר, משם התאים יכולים להתפזר לכל מקום בגוף, כך שאפשר היה לעקוב אחרי ההתפזרות שלהם ולראות לאן הם מגיעים", מסבירה פרופ' סצ'י-פאינרו. "בנוסף ביצענו גם הזרקות ישירות למוח, כדי לבדוק איך התאים שורדים וגדלים בסביבה המוחית".
בשלב האחרון הרחיבו החוקרים את הבדיקה גם לרקמות אנושיות. "לקחנו גרורות מהמוח של חולות סרטן שד ישירות מחדר הניתוח, בשיתוף פעולה עם חוקרים קלינאים שהם שותפים שלנו למחקר", הסביר פרופ' בן-דוד. "ובדקנו בגרורות את הביטוי של p53 ושל הגן שאותו הוא מבקר ושאחראי על ייצור חומצות השומן, SCD1. מצאנו שאכן הגרורות המוחיות מראות ירידה בפעילות של p53 עם עלייה בפעילות של SCD1, ושיש מתאם בין הפעילות הזו לבין נוכחותם של אסטרוציטים בגרורות. מעבר לכך, יכולנו גם לקחת את הגידולים עצמם, לשים אותם בתרבית, ולטפל בהם בתרופות כדי לראות איך הם מגיבים".
פוטנציאל טיפולי במקום שבו כמעט אין טיפול
לממצאים עשויות להיות בעתיד השלכות טיפוליות אפשריות - ואף דרמטיות. "לא רק שהמנגנון שגילינו חיוני ליצירתן של גרורות של סרטן שד במוח, אלא שהוא גם מהווה נקודת תורפה של הגרורות האלה. אם נתקוף את המנגנון הזה, נוכל לפגוע בגרורות במוח - תופעה שהיום אין לנו דרך לטפל בה בצורה טובה", אומר פרופ' בן-דוד.
"בדקנו את היעילות של מספר תרופות שמעכבות את הפעילות של SCD1. תרופות אלו נמצאות בשלבים שונים של פיתוח, והן נועדו במקורן למחלות אחרות, אך אנחנו מצאנו שעיכוב של SCD1 בתאי גרורות עם p53 פגוע הוא אפקטיבי, ופוגע משמעותית בהתפתחות הגרורות המוחיות – הן בעכברים והן בדגימות מגרורות מוחיות של נשים חולות סרטן שד". פרופ' סצ'י-פאינרו מוסיפה כי "בניסויים שערכנו בעכברים, ראינו שבעכברים שקיבלו את הטיפול, הטיפול עיכב משמעותית את התקדמות הגידול והעלה את אחוזי ההישרדות. זה מראה שיש פה פוטנציאל".
פרופ' בן-דוד: "המוטציה שזיהינו יכולה לשמש גם כסוג של ביומרקר. אם אנחנו יודעים שלחולה יש את השינוי הגנטי הזה, הסיכוי שלה לפתח גרורות למוח גבוה יותר. עבור חולות כאלה, ניתן יהיה לשקול מעקב הדוק יותר, כולל ביצוע בדיקות MRI של המוח – בדיקות שאינן חלק מהמעקב השגרתי אחרי חולות סרטן שד כיום"
מעבר לפוטנציאל הטיפולי העתידי, החוקרים מדגישים כי לממצאים עשויה להיות גם משמעות קלינית מיידית בניהול חולות סרטן השד. "המוטציה שזיהינו יכולה לשמש גם כסוג של ביומרקר", מסביר פרופ' בן-דוד. "המשמעות היא שבשלבים מוקדמים של המחלה ניתן לזהות חולות הנמצאות בסיכון מוגבר לפתח גרורות מוחיות. "אם אנחנו יודעים שלחולה יש את השינוי הגנטי הזה, הסיכוי שלה לפתח גרורות למוח גבוה יותר", הוא אומר. "עבור חולות כאלה, ניתן יהיה לשקול מעקב הדוק יותר, כולל ביצוע בדיקות MRI של המוח – בדיקות שאינן חלק מהמעקב השגרתי אחרי חולות סרטן שד כיום".
לממצאים עשויות להיות גם השלכות על קבלת החלטות טיפוליות. כיום עומד לרשות האונקולוגים מגוון רחב של תרופות ביולוגיות, אך רק חלק מהן מסוגלות לעבור את מחסום הדם-מוח. תרופות שכן חודרות למוח נוטות להיות כרוכות ביותר תופעות לוואי, ולעיתים קשה להכריע האם לבחור בטיפול האגרסיבי יותר או להעדיף תרופה נסבלת יותר, אך כזו שפחות אפקטיבית נגד גרורות מוחיות.
"לא תמיד יש דרך ברורה להחליט מה נכון לכל חולה", מציין פרופ' בן-דוד. לדבריו, היכולת להגדיר מראש אוכלוסייה של חולות המצויות בסיכון גבוה לגרורות במוח עשויה לשנות את נקודת האיזון הזו. "אם נוכל לזהות מי נמצאת בסיכון מוגבר, נוכל להתאים טוב יותר גם את המעקב וגם את הטיפול", הוא אומר. "לכן הרלוונטיות הקלינית של המחקר היא לא רק בפיתוח תרופות חדשות, אלא הוא גם עשוי להשפיע על האופן שבו מטופלות חולות סרטן שד כבר כיום – עם הכלים שכבר עומדים לרשותנו".
הפרויקט נתמך על-ידי קרן משפחת עידן ובתיה עופר וכן מענקי מחקר תחרותיים מטעם הקרן הלאומית למדע (ISF), הקרן לחקר הסרטן בישראל (ICRF) וקרן הבנק הספרדי Fundacion La Caixa. כמו כן, הוא מהווה חלק ממחקר רחב המתבצע במעבדתה של פרופ' סצ'י-פאינרו, בתמיכת Advanced grant של ה-European Research Council (ERC), ERC Proof of Concept (PoC) וקרן קאהן, וכן חלק ממחקר רחב המתבצע במעבדתו של פרופ' בן-דוד, בתמיכת Starting grant של ה-European Research Council (ERC).